第一部:化学と物質構造・イオン結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,イオン結晶について,【イオン結晶の構造】, 【代表的イオン結晶】 に項目を分けて紹介する。
イオン結晶の構造
陽イオンと陰イオンは静電的引力で引き合うが,同符号のイオンは静電的斥力で反発しあう。これにより,固体では,陽イオンと陰イオンが三次元的に交互に配列(イオン結晶)し,板状,柱状,針状など様々の特徴ある結晶構造を採る。
イオン結晶の配列は,静電的引力と斥力の作用には,陽イオンと陰イオンの大きさ(イオン半径)の違いの影響を受ける。
両イオンが同等の大きさの場合には,金属結晶のような最密充填( cubic close - packing )が可能であるが,イオンの大きさが異なると,小さいイオンの周りに接近した異符号の大きいイオン同士には斥力が働くため,金属結晶のような配位数 12 の最密充填構造を取れなくなる。
この結果として, NaClなど 2種の元素による AB型塩のイオン結晶(球状のイオンの結晶)の多くは,A と B のイオンサイズの比により,次の配位数( coordination number )の異なる 3種の構造をとる 。
① 配位数 8 (体心立方):陽イオン半径/イオン半径 > 0.732
② 配位数 6 (正八面体): 0.732 >陽イオン半径/陰イオン半径> 0.414
③ 配位数 4 (正四面体): 0.414 >陽イオン半径/陰イオン半径> 0.25
0.732,0.414 ,0.25 は,定められた構造で,同符号のイオンが互いに接触しないためのイオン半径比を示し,これを極限半径比という。
なお,AB 型以外のイオン結晶の構造は,化合物個別の問題となり一般化し難い。例えば,CaCl2 など AB2 型塩もイオン半径の比に関連した配位数が存在する。しかし,炭酸カルシウム( CaCO3 )など球状とならないイオンを含むイオン結晶は複雑な構造をとる。
配位数 8 (体心立方格子)の限界
極限半径比の求め方
【金属結合】で紹介するように,静電力の影響がなく,同じサイズの球状粒子で結晶を形成する場合には,配位数 12 の最も詰まった構造(最密充填構造)として,面心立方格子(立方最密充填構造),稠密六方格子(六方最密充填構造)の 2 種類の構造がとれる。
イオン結晶の場合では,【イオンサイズ】で紹介したイオン半径で理解されるように,同じサイズの陽イオンと陰イオンの化合物はないといってよい。
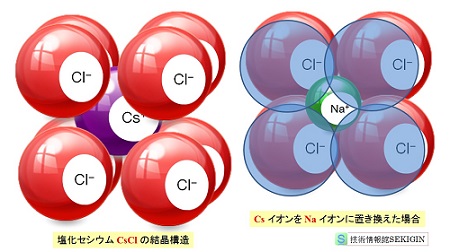
しかし,例えば,塩化セシウム( CsCl )のように,イオンサイズがセシウムイオン( Cs+ ) 167 pm (ピコメートル,10-12m )で,塩化物イオン( Cl-) 181 pm に近い場合には,最密充填構造に次いで密に詰まることができる配位数 8 の体心立方格子を形成できる。
陽イオンを,セシウムイオンよりイオン半径の小さいナトリウムイオン( Na+ ) 99 pm に置き換えると,塩化ナトリウムとなるが,塩化セシウムと同じ結晶構造を採ろうとすると,図に示すように,塩化物イオン同士の重なりが生じ,この構造をとれないことが分かる。
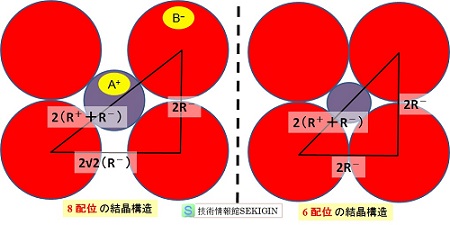
極限半径比の求め方
この関係から 陽イオンの半径( R+ )と陰イオンの半径( R- )の比を求めると,
R++R- = √3 R-
∴ R+/R- = √3-1 ≒ 0.732
となる。
同様にして,配位数 6 のままで陰イオンが接触する条件では,R+/R- = √2 -1 ≒ 0.414,配位数 4 の正四面体の頂点の陰イオンが接触するとき,重心の陽イオンとの半径比は R+/R- = 0.25となる。
【参考】
結晶構造( crystal structure , crystalline structure )
結晶中の原子の配置構造。例えば,配位数 12 の結晶構造では,球が密に積み重なる。これを最密充填構造(又は最密構造)という。第 3 段目の重なり方の違いで,六方最密充填( hexagonal close - packing ,ちょう密六方格子)と立方最密充填( cubic close - packing ,面心立方格子)に分けられる。
配位数 8 では,体心立方格子( body – centered cubic lattice )の構造に,配位数 6 では正八面体に,配位数 4 では正四面体になる。
配位数( coordination number )
分子,又は結晶における中心原子から最近接の原子の数を示す。結晶における詰まり方を表現する概念である。
ページのトップへ
代表的イオン結晶
塩化セシウム( CsCl )の結晶は,セシウムイオン( Cs+ ) 167 pm ,塩化物イオン( Cl-) 181 pm で(イオン比 0.92 )配位数 8 の体心立方格子構造となる。配位数 8 の結晶を一般的には塩化セシウム型構造ともいう。
塩化ナトリウム( NaCl )の結晶は,ナトリウムイオン( Na+ ) 99 pm ,塩化物イオン( Cl-) 181 pm で(イオン比 0.54 )配位数 6 の正八面体型の構造となる。配位数 6 の結晶を一般的には塩化ナトリウム型構造ともいう。
硫化亜鉛( ZnS )の結晶は,亜鉛イオン( Zn2+ ) 60 pm ,硫化物イオン( S2- ) 184 pm で(イオン比 0.33 )配位数 4 の正四面体型の構造となる。配位数 4 の結晶を一般的には硫化亜鉛型構造(閃亜鉛鉱型)ともいう。
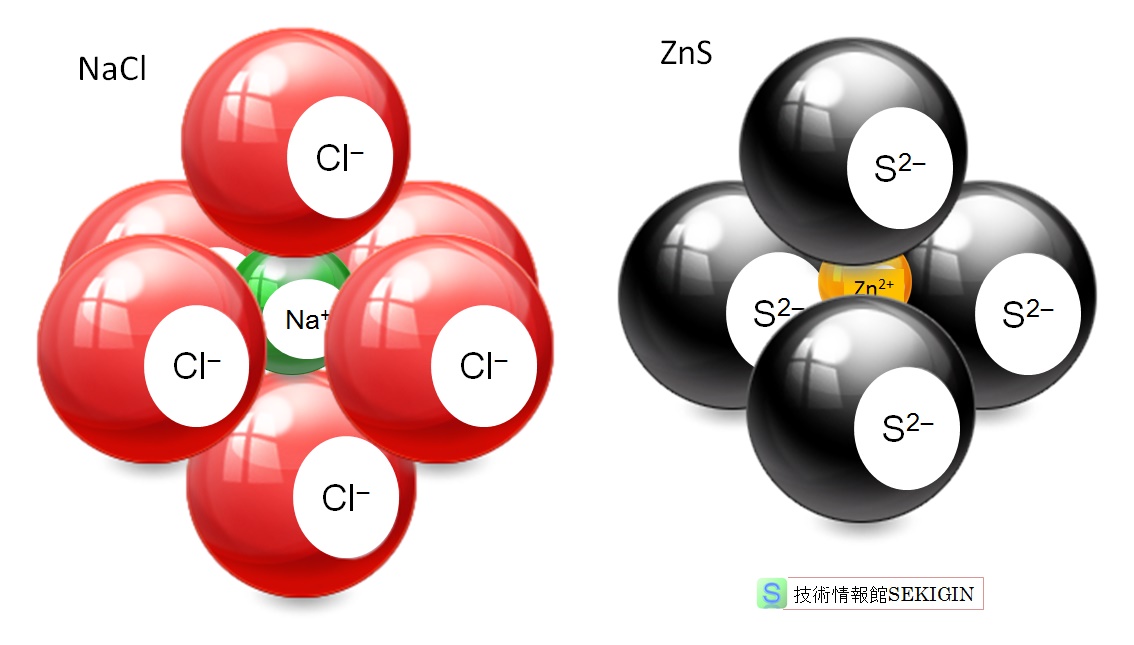
塩化ナトリウム,硫化亜鉛の結晶
ページの先頭へ