第三部:化学反応 化学平衡
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学反応の平衡を理解するために, 【化学反応の形態】, 【単純反応】, 【複合反応】, 【並発反応】 に項目を分けて紹介する。
化学反応の形態
これまでは,単純な反応の化学式を中心に紹介してきたが,工業的に実用される化学反応や,生体内での化学反応は,複雑な過程を経るものが少なくない。
化学反応は過程の違いで,一段階の反応で完結する単純反応( simple reaction ),複数の反応の組み合わせで進む多段階反応( multistage reaction )に分けられる。
多段階反応は,さらに,複合反応( complex reaction :連続反応,逐次反応,連鎖反応ともいう),並発反応( simultaneous reaction :競争反応,並行反応ともいう)に分けられる。
ここでは,主要な反応形態の分類と,それぞれについての概要と特徴を紹介する。
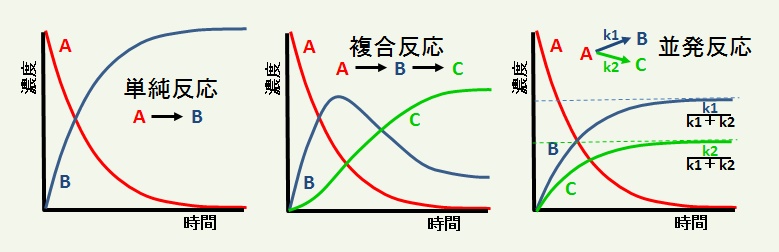
反応種別の濃度変化の特徴【模式図】
ページの先頭へ
単純反応
単純反応( simple reaction )とは,反応式で書き表されている反応物から生成物が直接生成する中間段階の無い反応である。
すなわち,反応速度の全反応次数が,反応の原系の成分数(化学量論係数)と合致するので,反応式から速度式が容易に導出できる。
この形態の反応の一般式は,
反応式: αA +βB +γC + ・・・ → α'A' +β'B' +γ'C' + ・・・
速度式: ν = k [A] P [B] Q [C] R ・・・
と表すことができ,速度式のべき乗係数(反応次数)が反応式の化学量論係数と一致( P =α,Q =β,R =γ ・・・)する。
例えば,水素( H2 )とよう素( I2 )からヨウ化水素( HI )を合成する反応がこれに相当し,化学量論的にも反応速度的にも 2 次反応である。
反応式: H2 + I2 → 2HI
速度式:ν= k [ H2 ] [ I2 ]
ページの先頭へ
複合反応
複合反応( complex reaction )は,多段階反応( multistage reaction )の一種で,連続反応( successive reaction ),逐次反応( consecutive reaction ),連鎖反応( chain reaction )などとも呼ばれ,例えば,A → ( B → C ) → D となる中間の段階 ( B → C )を経た反応である。
複合反応は,最終的な反応式には現れない反応中間体( reaction intermediate )又は中間生成物( intermediate product )を介する複数の反応過程を経由する。このため,単純反応と異なり,速度式のべき乗係数(反応次数)が反応式の化学量論係数よりも少なくなる。
複合反応のそれぞれ過程(A → B ,B → C ,C → D )を素反応(elementary reaction)と呼ぶ。複合反応は,複数の素反応と反応中間体を含んで反応が構成されている。このため,複合反応の反応速度式は,一般的に複雑な表記になる。
例えば,水素( H2 )と臭素( Br2 )から臭化水素( HBr )を合成する反応は,次の反応式に示すように,化学量論的には 2 次反応であるが,速度式は複雑な式となる。
反応式: H2 + Br2 → 2HBr
速度式:ν= k [ H2 ] [ Br2 ]1/2 /( 1 + k’ [ HBr ] / [ Br2 ] )
これは,単純反応で例示した同じハロゲン族のヨウ化水素の合成とは異なり,次に示す 5 段階の素反応による複合反応のためである。(ここで,Br・はラジカルを表す)
1) Br2 → 2Br・ (連鎖開始段階)
2) Br・+ H2 → HBr + H・ (連鎖成長段階)
3) H・+ Br2 → HBr + Br・ (連鎖成長段階)
4) H・+ HBr → H2 + Br・ (連鎖妨害段階)
5) 2Br・→ Br2 (連鎖停止段階)
複合反応の反応速度
複合反応全体の反応速度は,多くの場合に特定の素反応の影響を大きく受ける。最も遅い素反応を律速段階( rate-determining step )や律速過程という。
このため,反応速度式は,実験的に求められたべき乗係数と速度定数により複雑な表記となるのが一般的である。
なお,素反応がいくつあろうと,ヘスの法則に従い,反応熱は反応物と生成物のエネルギー差で一義的に決まる。このため,律速段階を明示するなど特殊な目的以外では,化学反応式の表記で反応中間体(遷移状態)の素反応を省くのが一般的である。
ページの先頭へ
並発反応
並発反応は,競争反応や並行反応などとも呼ばれ,同じ反応物(原料)から複数種の生成物が同時に生じる反応である。
例えば,反応物 A から A → B と A → C という反応が同時に進行する。この時,A → B ,A → C の反応は不可逆反応である。
それぞれの反応が 1 次反応の場合に,生成物 B と C の生成量の比は,それぞれの速度定数の比で表せる。
ページの先頭へ