第三部:化学反応 化学反応とエネルギー
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学反応の熱エネルギーに関連し,【反応熱とは】,【反応熱】,【反応熱の分類】に項目を分けて紹介する。
反応熱とは
反応熱を理解するため,はじめに電子の持つエネルギー,化合物の結合エネルギーについて復習する。
軌道電子のエネルギー
【原子の構造】で紹介したように,原子は,不連続のエネルギー順位を持つ電子軌道に分配された電子で覆われる。
複数の原子で構成される分子の電子は,エネルギー順位が関連原子の数だけ分裂した分子軌道に分配されることを【分子軌道について】や【エネルギーバンド】などで紹介している。
【イオン化エネルギー】及び【イオン化傾向】では,原子やイオンからの軌道電子の引き抜き易さ,すなわち電子を放出して陽イオンへのなり易さの目安として 3 種のエネルギー(イオン化エネルギー,仕事関数,酸化還元電位)を紹介している。
逆に,原子や分子が電子を受け取った陰イオンのなり易さの目安については,【電子親和力】で紹介している。
結合エネルギー
化学反応は,分子を構成する原子間の結合の生成,切断によって異なる分子を生成する現象である。
【化学結合とは】で紹介したように,物質は,電子対の共有,又は電子の授受による原子間の結合にょり構成されている。従って,化学反応は,分子の結合に関わる電子の授受,すなわち,物質の持つ結合エネルギー変化の過程と考えられる。
結合エネルギー( binding energy )とは,分子や結晶が,それらを構成する原子がばらばらに存在する状態との間での自由エネルギー(free energy)の差をいう。
すなわち,結合エネルギーは,分子の持つ全結合を切断するためのエネルギーの総和となる。なお,分子中の結合を一つ一つ切断するのためのエネルギーは,結合解離エネルギー( bond dissociation energy )という。
分子や結晶などの結合エネルギーの源は,それぞれの原子の最外殻電子の共有(共有結合),電子が移動することで発生するクーロン力(イオン結合)である。
ページの先頭へ
反応熱
化学反応は,熱力学第一法則(エネルギー保存則)に従うので,途中経過に関わらず最初の状態と最終状態が決まれば,化学反応で発生又は吸収される熱が決定される( ヘスの法則)。
反応熱( heat of reaction )
化学反応の最初の状態と最終状態の結合エネルギーの差に基づき,出入りする熱を反応熱という。
言い換えると,原理的には,
反応熱 =「生成物の結合エネルギーの総和」-「反応物の結合エネルギーの総和」
と書ける。
熱力学的には,反応熱は,対象とする系のエンタルピー変化に相当する。なお,エンタルピーの詳細や結合エネルギーの具体例などについては,別の項で紹介する。
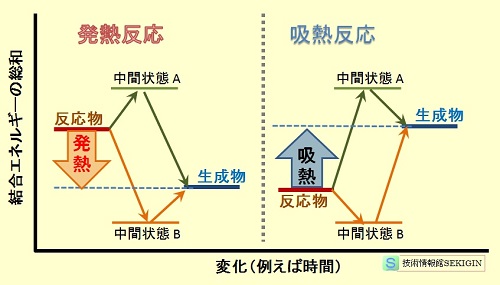
化学反応における反応熱(模式図)
化学反応は,どのような経路(中間状態)を経ようとも,反応物のエネルギー状態より生成物のエネルギー状態が低い場合に,エネルギーが外部に放出(発熱反応)する。
一方,エネルギー状態が反応物より生成物が高い場合には,反応開始のみならず反応を継続するためには,系外からエネルギーを与える必要がある。すなわち,反応系としてはエネルギーを外部から吸収(吸熱反応)する。
下図から直観的には,発熱反応は放置しても自然に進みやすいこと,吸熱反応は放置したのでは進みにくいことが分かる。
【参考】
熱力学第一法則( the first law of thermodynamics )
「孤立系のエネルギーの総量は変化しない。」という熱力学の基本法則の一つで,エネルギー保存の法則( the law of the conservation of energy )やエネルギー保存則とも呼ばれる。
ページの先頭へ
反応熱の分類
反応熱は,対象とする化学反応の形態によって,次のように分類される。
生成熱( heat of formation )
化合物 1 mol がその構成元素の安定な単体から生成するときに発生または吸収する熱。
一般的には,25 ℃ 1 気圧(標準状態)で発生する生成熱を標準生成熱といい,その標準生成エンタルピー変化(ΔfH0 )を用いる。
燃焼熱( heat of combustion )
化合物 1 mol が完全に燃焼(酸素と反応)するときに発生する熱。
25 ℃ 1 気圧(標準状態)の理想系で発生する熱量を標準燃焼熱と呼び,そのエンタルピー変化(ΔCH0 )を用いる。
溶解熱( heat of dissolution )
溶質 1 mol を溶媒(液体)に溶かしたときに発生または吸収する熱。
標準状態( 25 ℃,固体液体は 1 気圧,気体はフガシチー 1 )での溶解熱を標準溶解熱と呼び,そのエンタルピー変化(ΔsolH0 )を用いる。
中和熱( heat of neutralization )
酸と塩基とが中和する時に発生する熱量。
希薄水溶液中での強酸と強アルカリとの中和熱はそれらの種類にかかわらず一定で,水素イオン 1 mol と水酸化物イオン 1 mol から水 1 mol生成する時の反応熱( 56.5 kJ / mol ;25 ℃)に等しい。標準状態( 25 ℃),無限希釈状態における中和熱を標準中和熱と呼び,そのエンタルピー変化(ΔnH0 )を用いる。
以上の分類とは別に,化学反応式から反応熱を考慮する場合には,熱化学方程式で説明したように,化合物の状態変化(相変化)に伴う転移熱(蒸発熱,凝集熱,昇華熱などの潜熱)も考慮しなければならない。
ページの先頭へ