第三部:化学反応 化学反応とエネルギー
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,熱化学方程式の活用例として, 【燃焼熱を求める】, 【溶解熱・中和反応熱を求める】 に項目を分けて紹介する。
燃焼熱を求める
ここでは,熱化学方程式を用いた燃焼熱,中和熱の計算事例を紹介する。エンタルピーのデーターは,化学便覧(第五版)から抜粋したものを用いた。
メタンの燃焼反応は,既知(反応エンタルピー ΔrH0 = - 890.71 kJ /mol )であるが,ここでは,未知と仮定して求めてみる。
メタン( CH4 )の燃焼反応: CH4(g) + 2O2(g) → CO2(g) + 2H2O (l)
利用する標準生成エンタルピー( Δf H0 )既知の生成反応は次の通りである。
① メタンの生成 : C(s) + 2H2(g) → CH4(g) ; ΔfH0 = -74.87 kJ/mol
② 二酸化炭素の生成: C(s) + O2(g) → CO2(g) ; ΔfH0 = -393.509 kJ/mol
③ 水の生成 : H2(g) + 1/2O2(g) → H2O (l) ; ΔfH0 = -285.83 kJ/mol
ここで,
④:②から①を差し引くと,
C(s) + O2(g) -{ C(s) + 2H2(g) }→ CO2(g) - CH4(g)
∴ O2(g) - 2H2(g) → CO2(g) - CH4(g)
⇒ O2(g) + CH4(g) → CO2(g) + 2H2(g)
エンタルピー変化:ΔH = -393.509 - ( -74.87 ) = -318.639 kJ/mol
⑤:④に 2 ×③を加えると,
O2(g) + CH4(g) + 2 × [ H2(g) + 1/2O2(g) ]→ CO2(g) + 2H2(g) + 2 × [ H2O (l) ]
∴ CH4(g) + 2O2(g) → CO2(g) + 2H2O (l)
エンタルピー変化:ΔH = -318.639 + 2 × ( -285.83 ) = -890.299 kJ/mol
となり,メタン燃焼の反応エンタルピー(ΔrH0 = -890.71 kJ/mol )と同等の値が得られる。
反応温度の補正
上記の手法で熱力学的に求められた反応熱は,基準とする温度,すなわち 25 ℃での値である。しかし,多くの燃焼反応は,高い温度で起きる。従って,工学的には燃焼の起きる温度での反応熱が求められる。
標準温度( 25 ℃= 298.15 K )以外の温度の反応熱(ΔrH(TK) )は,反応系(反応物の混合系)と生成系(生成物の混合系)の熱容量の差Δ Cp を用いて,次式で補正できる。
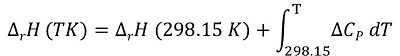
温度補正式
ページの先頭へ
溶解熱・中和反応熱を求める
ここでは,熱化学方程式を用いた溶解熱,中和熱の計算事例を紹介する。エンタルピーのデーターは,化学便覧(第五版)から抜粋したものを用いた。
溶解熱( heat of dissolution )
溶質 1mol が溶媒(液体)に溶かしたときに発生,又は吸収する熱である。標準状態( 25 ℃,1 気圧 )の溶解熱は標準溶解熱(ΔsolH0 )と呼ぶ。
中和熱( heat of neutralization )
酸と塩基とが反応する時に発生する熱である。希薄水溶液中の強酸と強アルカリとの中和熱はそれらの種類にかかわらず一定で,水素イオン 1 mol と水酸化物イオン 1 mol から水 1 mol 生成する時の反応熱( 56.5 kJ /mol ;25 ℃)に等しい。標準状態( 25 ℃),無限希釈状態における中和熱を標準中和熱(ΔnH0 )と呼ぶ。
溶解熱,中和熱計算例
多量の水( aq )に 2 mol の水酸化ナトリウム(固体: NaOH )を溶解し,次いで 1 mol の硫酸(液体: H2SO4 )を徐々に加えた時,発生する熱量を計算してみる。
この場合は,次の 3 段階の反応を考える。
① 固体の水酸化ナトリウムを水に溶解(溶解反応)
NaOH(s) + aq → NaOH aq ; ΔsolH0 = -44.52 kJ/mol
② 液体の硫酸を水に溶解(溶解反応)
H2SO4(l) + aq → H2SO4 aq ; ΔsolH0 = -95.28 kJ/mol
③ ①と②の混合,すなわち水和した水酸化ナトリウムと水和した硫酸の反応(中和反応)
2NaOH aq + H2SO4 aq → Na2SO4 aq + 2H2O ; ΔnH0 = -56.5 kJ/mol
ここで,全体の反応として,中和反応前の混合水溶液の状態④を考える。
④ 溶解反応について: ①× 2 に②を加えると,
2NaOH(s) + H2SO4(l) + aq → 2NaOH aq + H2SO4 aq
エンタルピー変化:ΔH = -44.52 ×2 + ( -95.28 ) = -184.32 kJ/mol
⑤ ④と中和反応(③× 2 )を加えることで,中和反応全体の反応熱が計算できる。
2NaOH(s) + H2SO4(l) + aq →H2SO4 aq + 2H2O
エンタルピー変化:ΔH = -184.32 + 2×( -56.5 ) = -297.32 kJ/mol
ページの先頭へ