第三部:化学反応 化学反応速度
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学反応の速度に関連し, 【反応速度とは】, 【反応熱と反応速度】, 【酸化物,水酸化物生成反応の熱化学方程式の例】 に項目を分けて紹介する。
反応速度とは
反応速度( reaction velocity ,reaction rate )
一般的には,化学反応において,反応物(又は生成物)の量の時間変化率を表す物理量と定義される。
化学反応が進むことで,反応物や生成物の物質量,濃度,又は体積が時々刻々と変化する。反応物又は生成物の中から特定の物質に注目し,ある時間間隔で計測可能な物理量の変化を求め,「変化量」÷「時間間隔」で求められる計測間隔での平均値を反応速度とするのが一般的である。
疑問:計測する時間間隔について,特に規定がない。すなわち,時間間隔を変えた場合に得られる結果が異なる場合に,どの値をその反応の速度とすべきなのか?
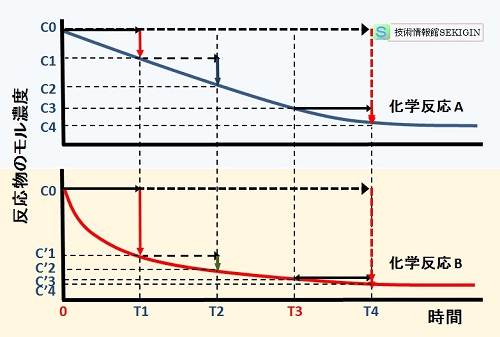
反応物濃度の時間変化【模式図】
図の上部は,ほぼ等速で反応物の濃度が低下する反応(化学反応 A )を想定した場合である。この場合には,時間 T4 反応平衡の濃度 ( C4 ) に至る
図の下部は,上の化学反応 A とは形式が異なり,初期の濃度変化が激しく,時間と共に変化割合が小さくなる化学反応 B を想定した。
ここで,両反応の初期濃度 ( C0 ) が同じと仮定し,反応物の濃度測定タイミングの反応速度評価結果に与える影響を考える。
同じ時間間隔での濃度変化量
化学反応 A : ( C0 – C1 ) > ( C1 – C2 ) > ( C2 – C3 ) >( C3 – C4 ) > ( C4 – C5 ) ≒ 0
化学反応 B : ( C0 – C’1 ) ≫ ( C’1 – C’2 ) > ( C’2 – C’3 ) >( C’3 – C’4 ) > ( C’4 – C’5 ) ≒ 0
このように,時間と共に濃度変化量が減少,すなわち濃度変化量を測定時間間隔で割って得られる反応速度は時間と共に減少する。
化学反応 A と B の比較
時間 T1 で濃度測定
濃度変化量 ( C0 – C1 ) <濃度変化量 ( C0 – C’1 ) から,化学反応 A <化学反応 B と評価される。
時間 T1 と時間 T2 で濃度測定
( C0 – C2 )/( T2 – T0 ) < ( C0 – C’2 )/( T2 – T0 ) から,化学反応 A <化学反応 B となるが,( C1 – C2 )/( T2 - T1 ) > ( C’1 – C’2 )/( T2 - T1 ) では,化学反応 A >化学反応 B と評価される。
このように,反応物の濃度を計測して,いわゆる反応速度を求めた場合に,同じ時間間隔であっても,計測タイミングの違いで計測値が大きく異なる場合があることが分かる。
化学反応速度は,物理学における等速度運動と同じ扱いで求めることが多いが,本質的には,化学反応の多くは,物理学における加速度運動の様に変化するため,測定した濃度を測定に要した時間間隔で割ったものを反応速度として扱うのは間違いで測定時間を明記した上で“平均速度”というべきである。
これらの数学的な扱いについては,【反応速度式とは】で紹介する。
ページの先頭へ
反応熱と反応速度
熱化学方程式からは,標準生成エンタルピーを比較することで,その化学反応が自発的(負のエンタルピー:発熱反応)に起こるか,外部からエネルギーを与えなければ進まない(正のエンタルピー:吸熱反応)かが分かる。
疑問:自発的に起こる発熱反応について,その反応が速やかに進むのかゆっくり進むのかを反応熱の大きさから推定できるのだろうか?
例えば,次項には,身近な金属について,酸素との酸化物生成反応,及び水との水酸化物生成反応に関する熱化学方程式を示している。
経験的に,金属ナトリウム( Na )は,酸素・水との接触で爆発的な速さで酸化するのに対し,鉄( Fe )は,ナトリウムと同じ物質量で比較すると,複数年という時間をかけて徐々に酸化することが知られている。
何れの酸化反応も,標準生成エンタルピーが負(発熱反応)で,自発的に起きる反応であるが,反応の発熱量は,経験される反応の速さとは逆に,鉄がナトリウムより大きい。
このように反応速度は,反応熱のみで単純に評価できないことが分かる。
反応速度に影響する要因については,【速度定数と活性化エネルギー】で紹介する。
ページの先頭へ
酸化物,水酸化物生成反応の熱化学方程式の例
酸化物生成反応
2Al (s) + 3O2 (g) → Al2O3 (αコランダム) ΔfH0 = -1675.7 kJ/mol
Ti (s) + O2 (g) → TiO2 (アナターゼ型) ΔfH0 = -939.7 kJ/mol
2Fe (s) + 3O2 (g) → Fe2O3 (s) ΔfH0 = -824.2 kJ/mol
Ca (s) + 1/2O2 (g) → CaO (s) ΔfH0 = -635.09 kJ/mol
Mg (s) + 1/2O2 (g) → MgO (s) ΔfH0 = -601.7 kJ/mol
2Na (s) + 1/2O2 (g) → Na2O (s) ΔfH0 = -414.6 kJ/mol
Zn (s) + 1/2O2 (g) → ZnO (s) ΔfH0 = -348.28 kJ/mol
Cu (s) + 1/2O2 (g) → CuO (s) ΔfH0 = -157.3 kJ/mol
水酸化物生成反応
Ca (s) + 2H2O (l) → Ca(OH)2 (s) + H2 (g) ΔfH0 = -986.04 kJ/mol
Mg (s) + 2H2O (l) → Mg(OH)2 (s) + 2H2 (g) ΔfH0 = -924.54 kJ/mol
Zn (s) + 2H2O (l) → Zn(OH)2 (s) + 2H2 (g) ΔfH0 = -641.91 kJ/mol
Fe (s) + 2H2O (l) → Fe(OH)2 (s) + 2H2 (g) ΔfH0 = -569 kJ/mol
Cu (s) + 2H2O (l) → Cu(OH)2 (s) + 2H2 (g) ΔfH0 = -449.8 kJ/mol
Na (s) + 2H2O (l) → NaOH (s) + 1/2H2 (g) ΔfH0 = -425.609 kJ/mol
ページの先頭へ