第三部:化学反応 電気化学
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電気化学を理解するため,電極反応の具体例として, 【電池とは】, 【電池の原型(ボルタ電池)】, 【古典的実用電池(ダニエル電池)】, 【鉛蓄電池】, 【リチウム電池】, 【燃料電池】 に項目を分けて紹介する。
電池とは
電極反応( electrode reaction )の理解を深めるため,化学物質の酸化還元反応( oxidation-reduction reaction )を利用して電気を取り出す電池( cell )の基本原理を紹介する。
ここで紹介する電池は,電池の原型であるボルタ電池( voltaic cell ),最初に実用されたダニエル電池( Daniel cell ),広く用いられている鉛蓄電池( lead-acid battery )やリチウム電池( lithium battery ),発電を目的とする燃料電池( fuel cell )である。
なお,電池の種類が異なると電圧(起電力)が異なる理由については【起電力と電気量】で紹介する。
電池の表示法
電池は,電池式(電池図)と呼ばれる固有の表記法を用いて記述する。
アノード(負極,陽極)となる電極系を左に,カソード(正極,陰極)になる電極系を右に書く。
電極系は,金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している。電池式では,状態の異なる相は記号 | で区切り,異なる溶液は記号 || で区切る。
例えば,後述のボルタ電池では,アノードの亜鉛板とカソードの銅板が希硫酸( H2SO4 )に浸漬されているので,電池式は,
Zn | H2SO4 (aq) | Cu
と表示する。
ダニエル電池の電池式は,アノードが亜鉛板と硫酸亜鉛( ZnSO4 )水溶液で構成され,カソードが銅板と硫酸銅( CuSO4 )水溶液で構成され,陶板で分離されているので,
Zn | ZnSO4 (aq) || CuSO4 (aq) | Cu
と表示する。
備考; 一般でいうところの電池式は,JIS K 0213 「分析化学用語(電気化学部門)」においては,電池図と表記している。
基礎用語
JIS K 0213 「分析化学用語(電気化学部門)」に定義される用語。
電池( cell )
一対の電極を電解質溶液に浸した系。
電極( electrode )
広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。
電解質溶液( electrolytic solution )
電気伝導性をもつ溶液。イオン性物質を水などの極性溶媒に溶解して調製する。
起電力( electromotive force )
ガルバニ電池の外部回路に流れる電流を減少させて,ゼロになるときの電池の電位差の極限値。ただし,電池の電位差は,いわゆる電池図の右側の電極に取り付けた金属端子の内部電位から左側の電極に取り付けた同種の金属端子の内部電位を差し引いたものである。
ガルバニ電池( galvanic cell )
一対の半電池から構成した電池。
半電池( half-cell )
金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む,少なくとも二つの相が直列に接触している系。二つの半電池を組み合わせれば電池を構成することができる。
局部電池( local cell )
電解質溶液中に浸した金属単体,合金などに局部的な電位差が生じ,金属表面の局部で電流が流れることで形成される電池。金属腐食の原因の一つとなる。
ページの先頭へ
電池の原型(ボルタ電池)
硫酸( H2SO4 )水溶液(希硫酸)に,銅板と亜鉛板を浸漬し,銅板と亜鉛板を導線で結ぶと,水素を発生しながら亜鉛が溶解し,導線に電流が流れる。
この電池は,銅板が正極(+極),亜鉛板が負極(-極)となる。
起電力( electromotive force , EMF )は,浸漬直後は 1.1 V であるが,その後時間と共に約 0.4 V まで低下する。この原因として,時間と共に電極表面の変化(酸化)に加えて,水素過電圧( hydrogen overvoltage )の影響と考えられている。
この電池は,放電のみで充電ができないので,一次電池と呼ばれる。電位差が安定した時の電極反応は次の通りである。
Zn(s) + 2H+ → Zn2+ + H2(g)↑
半反応式
亜鉛板表面 : Zn(s) → Zn2+ + 2e-
銅板表面 : 2H+ + 2e- → H2(g)↑
Zn(s)の(s)は固体状態を,H2(g)の(g)は気体状態を示し,↑は気体として系から除去されることを意味する。
【参考:電極の名称】
● 電池の陽極と陰極
電池の放電において電池活物質に電子を与える電極を陽極という。正極(+極),カソードとなる。
電池の放電において電池活物質から電子を受け取る電極陰極という。負極,アノードとなる。
電池活物質( cell active material )とは,電池の放電によって電極に電子の授受を行う物質を示す。
● 正極( positive electrode , cathode )と負極 ( negative electrode , anode )
電池において,その放電時に外部回路から電子が流れ込む,又は外部回路に向かって正電荷が流れ出す電極を正極 といい,
電池において,その放電時に外部回路から正電荷が流れ込む,又は外部回路に向かって電子が流れ出す電極を負極 という。
● カソード( cathode )とアノード( anode )
還元反応を生じる電極をカソードといい,
酸化反応を生じる電極をアノードという。
ページの先頭へ
古典的実用電池(ダニエル電池)
ボルタ電池の水素発生,起電力の不安定を解消し,実用可能な電池として開発された。
硫酸銅( CuSO4 )水溶液に銅板を,硫酸亜鉛( ZnSO4 )水溶液に亜鉛板を浸漬し,溶液間でイオンの移動が可能な半透膜(陶器の板)を介して接触させ,銅板と亜鉛板を導線で結ぶと,水素発生を伴わないで導線に電流が流れる。
この電池は,銅板が正極(+極),亜鉛板が負極(-極)となり,電位差 1.1 V の一次電池である。
Zn(s) + Cu2+ → Zn2+ + Cu(s)↓
半反応式
亜鉛板表面 : Zn(s) → Zn2+ + 2e-
銅板表面 : Cu2+ + 2e- → Cu(s)↓
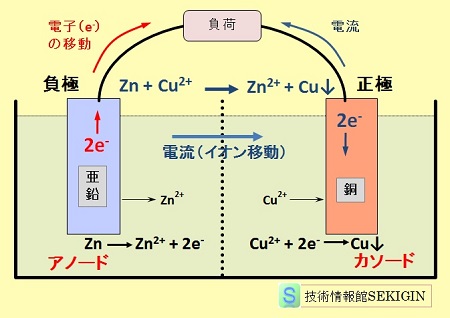
ダニエル電池の原理図
ページの先頭へ
鉛蓄電池
硫酸水溶液( 30~35%)を電解液として用い,鉛の格子に二酸化鉛( PbO2 )を充填した正極(+極),鉛の格子に海綿状の金属鉛を充填した負極(-極)とする起電力約 2 V の充電可能な二次電池(蓄電池)である。
電池の放電時には次の反応が起こる。
PbO2(s) + Pb(s) + 2H2SO4 → 2PbSO4(s) + 2H2O
半反応式
金属鉛表面(酸化反応) : Pb(s) + SO42- → PbSO4(s) + 2e-
酸化鉛表面(還元反応) : PbO2(s) + 4H+ + SO42- + 2e- → PbSO4(s) + 2H2O
なお,電池反応(放電)で生成する硫酸鉛( Pb SO4 )は,溶解度 0.0425g/L と小さいので電極表面に析出する。充電では,次項の【電気分解】で紹介するように,外部から与えられたエネルギーにより,放電時と逆の反応(硫酸鉛の酸化と還元)が進み電極が復活する。
放電時の様子を模式図に示す。電池の電極は,JIS K 0213 の定義に従うと,酸化反応の起きる金属鉛の電極がアノードとなる。アノードから電子が外部回路に向かって流出するので負極であり,電池活物質( Pb )から電子を受け取るので陰極となる。
一方,還元反応の生じる酸化鉛の電極がカソードとなり,外部回路から電子が流入するので正極であり,電池活物質( PbO2 )に電子を与えているので陽極である。
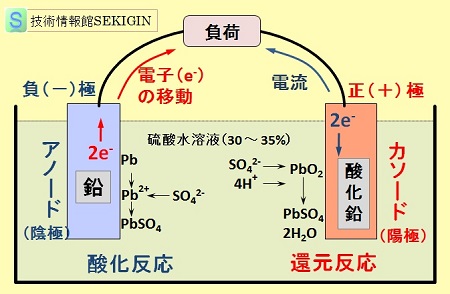
鉛電池・放電【模式図】
ページの先頭へ
リチウム電池
リチウム電池(リチウムイオン電池)には,電解液や正極の材料が異なる多くの一次電池,二次電池がある。
一般的なコイン電池やボタン電池と呼ばれる一次電池は,有機溶媒にリチウム塩を溶解させたものを電解液として用い,二酸化マンガン( MnO2 )を正極(+極),金属リチウムを負極(-極)とする起電力約 3 V の一次電池である。
2MnO2(s) + Li(s) → LiMn2O4(s)
半反応式
リチウム表面 : Li(s) → Li+ + e-
二酸化マンガン表面 : 2MnO2(s) + Li+ + e- → LiMn2O4(s)
ページの先頭へ
燃料電池
燃料電池には,用いる燃料(水素,アルコール,炭化水素),電解質(固体高分子,リン酸,溶融した炭酸塩,固体酸化物)の組み合わせで多くの種類がある。
燃料電池の最大の特徴は,この電池の起電力は,燃料を供給し続けることで,発電容量の制限を受けず大容量の電池を構成できることである。
例えば,燃料電池自動車への応用が期待される水素燃料電池(起電力 1.2 V )は,固体の高分子イオン交換膜を電解質として用い,イオン交換膜を挟んで水素と空気を通じる構造である。
2H2(g) + O2(g) → 2H2O
半反応式
水素側では,電極表面の水素が酸化反応で水素イオンと電子になる。
2H2(g) → 4H+ + 4e-
発生した電子は外部回路を通じて酸素側の電極に移動する。水素イオンは,イオン交換膜内を拡散し空気側の電極に移動し,空気中の酸素の還元反応に利用される。
O2(g) + 4H+ + 4e- → 2H2O(l)↓
H2O (l)↓は,系から除去されることを示す。
ページの先頭へ