第三部:化学反応 電気化学
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電気化学の基礎として,金属の酸化還元に関連し, 【金属のイオン化傾向】, 【熱力学的イオン化傾向】, 【実環境での金属単体の反応性】, 【不働態化で酸化還元反応が抑制される金属】 に項目を分けて紹介する。
金属のイオン化傾向
金属の酸化反応,すなわち,金属原子が電子を失う反応では,陽イオンへのなり易さの影響を強く受けていると考えることができる。金属元素の酸化反応のしやすさ,すなわち金属元素の陽イオンへのなり易さについて紹介する。
イオン化傾向とは
原子の陽イオンへのなり易さの尺度として,一般的には,イオン化エネルギー,電気陰性度,及び酸化還元電位が挙げられる。
【イオン化エネルギー】(ionization energy)
気体状態の単原子(又は基底状態の分子)から原子やイオンなどから電子を取り去るのに要するエネルギー,すなわち,取りだされた電子の結びつきの強さの目安で,エネルギーが小さいほど陽イオンになり易く,陽性が強いという。
【電気陰性度】( electronegativity )
化学結合にあずかる電子(共有電子対)を引き寄せる力の強弱を表す尺度である。一般的には,電気陰性度の小さい元素は,陽性が強く(陽イオンになり易い),大きい元素は,陰性が強い(陰イオンになり易い)と考えてよい。
【酸化還元電位】(redox potential)
水溶液中など酸化還元反応が起きる場(反応系)での電子授受で発生する電極電位を酸化還元電位という。 酸化還元電位は,規定する条件下において,反応にあずかる物質の電子の放出しやすさ,又は受け取りやすさを定量的に評価する尺度となる。
ここでは,身近な環境を想定し,理想状態の熱力学から求められる標準電極電位(標準酸化還元電位)から求められるイオン化傾向,実環境での酸化反応性について紹介する。
ページの先頭へ
熱力学的イオン化傾向
高等学校では,金属のイオン化傾向の大きい方から順に並べた金属のイオン化列として,Li, K, Ca, Na , Mg , Al, Zn, Fe , Ni , Sn, Pb , ( H ) , Cu , Hg , Ag , Pt , Au と教えている。
この順列は,【標準酸化還元電位】で紹介した金属単体の標準電極電位の順位である。
下図には,身近な金属元素について標準電極電位を示したものである。この順列には,先のイオン化列に Ti , Mn , H2O , Cr , Co を加えている。
疑問: 下図によると,アルミニウム( Al )やチタン( Ti )は,熱力学的には鉄( Fe )よりイオンになり易い。にもかかわらず,実環境では,鍋やフライパンなど調理器具にアルミニウムが,生体内に埋め込む材料としてチタンが用いられている。
アルミニウム( Al )やチタン( Ti )は,熱力学的にイオンになり易いのに,実環境で安定して存在できるのはなぜ?
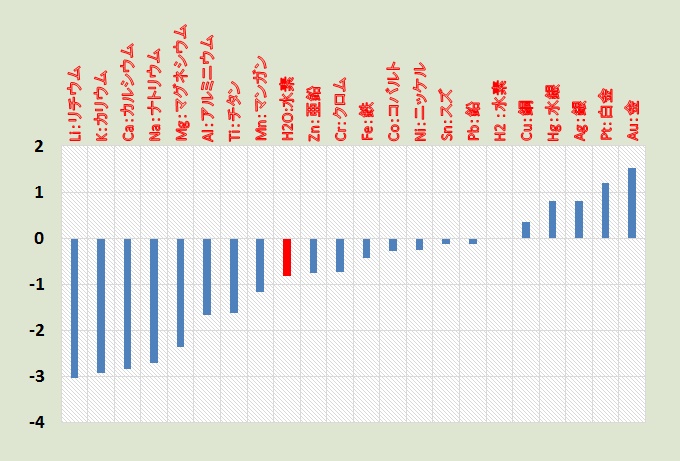
主な金属の標準電極電位 ( V vs.SHE ) 比較
ページの先頭へ
実環境での金属単体の反応性
ここでは,実環境における金属単体の反応性(イオン化傾向)を理解するため,正確性に欠けるが,日常で経験される大気成分,水溶液(中性,酸・塩基)での金属単体の反応性を整理した。
この結果は,標準電極電位の順列と大きく異なる金属が多い。この原因は,金属表面に環境成分との反応(酸化)で生成・付着した酸化物(水酸化物)の被膜の特性を反映していると考えられる。特に,不動態化と称される現象のとき順列が大きく異なる。
【大気成分との反応性】
乾燥空気中で酸化が進む: カリウム( K ),ナトリウム( Na )
湿気空気中で酸化が進む: リチウム( Li ),カルシウム( Ca ),マグネシウム( Mg ),鉄( Fe )
空気中での反応は緩やか: 亜鉛( Zn ),マンガン( Mn ),鉛( Pb ),銅( Cu )
空気中ではほとんど反応しない: アルミニウム( Al ),チタン( Ti ),クロム( Cr ),コバルト( Co ),ニッケル( Ni ),銀( Ag ),スズ( Sn )
空気中でまったく変化しない: 水銀( Hg ),白金( Pt ),金( Au )
【水溶液との反応性】
中性水と反応し水素発生・発火: リチウム( Li ),カリウム( K ),ナトリウム( Na )
中性水と反応し水素発生: カルシウム( Ca )
溶存酸素があると中性水と反応: マンガン( Mn ),鉄( Fe ),亜鉛( Zn )
塩酸,硝酸に溶解: マグネシウム( Mg ),コバルト( Co ),スズ( Sn ),鉛( Pb )
塩酸に溶解するが硝酸に不溶: クロム( Cr ),ニッケル( Ni ),アルミニウム( Al ),鉄( Fe )
塩酸に不溶だが硝酸に溶解: 銅( Cu ),銀( Ag ),水銀( Hg )
塩酸や硝酸に不溶: チタン( Ti ),白金( Pt ),金( Au )
【参考】
不動態( passive state )
これまでの文献等では,用語として不働態を用いていたが,現在は,JIS 用語を含め,不動態を用いる例が多い。
不動態とは,JIS Z 0103 「防せい防食用語」では,“標準電位列で卑な金属であるにもかかわらず,電気化学的に貴な金属であるような挙動を示す状態。”と定義している。
一般的には,金属をとり囲む環境の影響で,電気化学列で卑な金属(腐食しやすい金属)が,表面を酸化物で覆われるなどして本来の活性を失い,貴な金属のように挙動する状態を不動態といい,この状態になることを不動態化(passivity)と理解されている。
不動態化は,酸化力のある酸にさらされた場合,陽極酸化処理によっても生じる。不動態となる酸化被膜(不動態被膜)の典型的な厚みは,数 nm である。
すべての金属が不動態となるわけではなく,不動態になりやすいのは,アルミニウム,クロム,チタンなどやその合金である。
ページの先頭へ
不動態化で酸化還元反応が抑制される金属
マグネシウム( Mg )
大気中や中性水中で表面に水酸化マグネシウムと二酸化炭素により保護性の塩基性塩を形成し酸化還元反応が抑制される。塩化物イオンが存在するとこの被膜が形成されず水素を発生して酸化反応が進む。
アルミニウム( Al )
大気中で容易に保護性の自然酸化被膜(酸化アルミニウム,水和酸化物)の形成で不動態化し,多量の塩化物イオンを含まない中性水に耐える。
チタン( Ti )
大気中で容易に保護性の酸化被膜を作る。酸化チタン(Ⅳ)は,化学的に非常に安定な化合物で,通常の酸・塩基に対して優れた耐性がある。
亜鉛( Zn )
大気中では,保護性のある不溶性の塩基性炭酸亜鉛の被膜で覆われ,酸化還元反応を抑制される。淡水中では,水中の炭酸イオンによる保護性の被膜を作るが,硝酸塩,硫酸塩や塩化物の影響を受けた酸化物被膜の保護性は低い。
鉄( Fe )
鉄酸化物の保護性は低いが,酸化性の酸,塩基性の緻密な保護性被膜を形成し不動態化する。
クロム( Cr )
酸化クロムの被膜で不動態化し,大気,中性水,酸化性環境に耐えるが,濃い塩酸には溶解する。
ニッケル( Ni )
大気中,中性水中,濃硝酸では,水酸化ニッケルの被膜で不動態化するが,非酸化性酸や希硝酸には絶えない。
すず( Sn )
大気中や中性水中では,保護性の酸化すず被膜で覆われ不動態化する。大気中の硫化水素や亜硫酸ガスに対しても保護性の硫化すずの被膜を形成し不動態化するが,ハロゲンや亜硝酸ガスに対しては保護性被膜を形成しない。
鉛( Pb )
純水中では溶存酸素により溶解するが,大気や中性水に二酸化炭素,炭酸塩,ケイ酸塩などが存在すると難溶性で緻密な酸化物被膜を作り不動態化する。常温では塩酸,硝酸への溶解性は低いが熱すると溶解する。
【参考】
両性物質( amphoteric substance )
酸とも塩基とも反応する物質のことである。一般には,この性質を持つ金属単体(亜鉛,スズ,鉛,アルミニウム,ベリリウムなど)を両性金属,金属や半金属(一般的にはホウ素、ケイ素、ゲルマニウム、ヒ素、アンチモン、テルルの6元素)の酸化物で酸・塩基と反応する両性酸化物を合わせて両性物質と称している。両性酸化物を形成する物には,Zn, Sn, Pb, Al, Be, Si, Ti, V, Fe, Co, Ge, Zr, Ag, Sn, Au などが知られている。
ページの先頭へ