第三部:化学反応 化学反応速度
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学反応の開始し易さに影響する最大の要因に関し, 【活性化エネルギーとは】, 【触媒とは】 に項目を分けて紹介する。
活性化エネルギーとは
活性化エネルギー( activation energy )
物質がある状態から他の状態に変わる時,乗り越えなければならないポテンシャル障壁の高さをいう。
具体的には,化学反応における反応物の状態(基底状態)から,生成物の状態(基底状態)に変化する際に,経過しなければならない遷移状態に励起するために必要なエネルギーである。
反応開始と活性化エネルギー
化学反応は,【反応熱とは】で紹介したように,どのような反応経路を通っても,反応熱は反応物(出発物質)と生成物(最終物質)の基底状態のエネルギー差で決まる(ヘスの法則)。
すなわち,発熱反応は,反応の進行で,反応熱に相当するエネルギーが取り出される。吸熱反応では,少なくともエネルギー差に相当する量を外部から受け取らなければ反応が継続しない。
しかし,実際に反応が開始するためは,前項の【活性化とは】で紹介したように,反応物と生成物の間のエネルギー差だけでは十分に説明できない。
すなわち,吸熱反応を開始するためには,反応物と生成物のエネルギー差以上の遷移状態まで励起できるエネルギーが必要となり,自発的に進行する発熱反応であっても,引き金として遷移状態を超えるエネルギーを与えないと進行しない場合が少なくない。
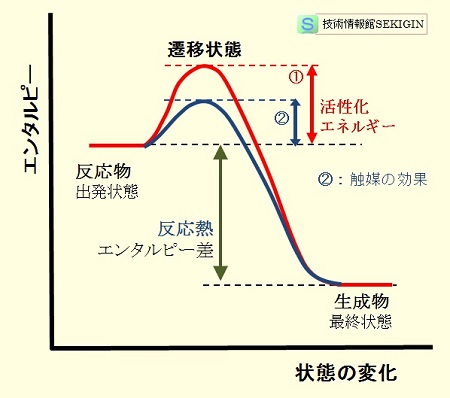
化学反応でのエネルギー推移(活性化エネルギー)
活性化エネルギーの大きい反応では,外部から熱などのエネルギーを多く与える必要があり,活性化エネルギーが小さい場合は,外部から与えるエネルギーが低くて済み,常温( 25 ℃程度)でも活性化エネルギーを超えることができる場合がある。
このように,化学反応の開始は,反応熱(反応物と生成物の基底状態の差)の大小に依らず,活性化エネルギーの大小に影響される。
反応経路と活性化エネルギー
右図は,発熱反応の過程を分子の持つエネルギーの推移として模式的に示したものである。この時の活性化エネルギーは,反応物と遷移状態のエネルギー差①となり,このエネルギーを超えることで,反応が開始し,①+反応熱のエネルギーを放出する。
逆反応(吸熱反応)では,図の反応物と生成物を入れ替えた状態となる。この時の活性化エネルギーは,図の①+反応熱と大きなエネルギーが必要となる。
化学反応の反応経路を変えても,ヘスの法則に従い,反応熱は変化しないが,活性化エネルギーを変えることができる。活性化エネルギーを低くすることを目的に,反応経路を意図的に変更する際に活用されるのが触媒( catalyst )である。
ページの先頭へ
触媒とは
触媒( catalyst )
化学反応の反応速度を高める目的で用い,反応前後で変化しない物質,又は反応後に再生して元に戻る物質をいう。
触媒には,溶液に溶かして用いる均一系触媒(酸触媒,塩基触媒,酵素など),固体として用いる不均一系触媒(白金,パラジウム,ニッケルなどの固体やこれらの微粉末をセラミックスや活性炭に保持したもの)に分類される。
また,生化学の分野では,生体中で触媒として機能するタンパク質(酵素)を抽出したものを生体触媒として分類することもある。
触媒の作用
触媒と反応物の相互作用で反応中間体を形成することで,活性化エネルギーの低い遷移状態(上図の②)を経て生成物を生み出すことができる。
このため,与えられた系の熱条件で,反応開始に必要な熱エネルギーを低く抑えるため,反応に関与できる分子数が増加する。この結果として,次項の【反応速度式】で紹介するように,反応速度を高めることができる。
一般的な説明では,反応物が,活性サイトと呼ばれる触媒表面の特定部位,又は分子上の特定位置に吸着し,活性化エネルギーの低い活性錯体を形成するためと説明されている。
実際の作用は複雑であり,特殊条件が満たされた場合に成立する作用で,次のような説明がある。
分子の吸着
分子吸着により,触媒表面では気体中,又は液体中より分子密度が高くなる(圧縮効果)。触媒として有効に働くのは,圧縮効果に加えて,反応物の分子が分解して吸着する解離吸着(化学吸着)が起こるためと考えられる。
活性点
単に吸着するのではなく,吸着した分子が反応できる適切な配置により,触媒としての効果が発揮される。この場所を活性点といい,触媒の種類と反応の種類によって異なる。
反応過程
分子の衝突による単一過程の反応と異なり,少なくとも,反応物の吸着,表面での反応,表面からの生成物脱離の三過程を経る別ルートでの反応が起きる。この場合に,活性化エネルギーは,それぞれの過程に存在する。各過程の活性化エネルギーが単一過程での活性化エネルギーより低くなる。
ページの先頭へ