第三部:化学反応 電気化学
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電気化学を理解するため,電極反応の具体例として, 【めっきとは】, 【電解めっき(電気めっき)原理】, 【電解めっき条件】 に項目を分けて紹介する。
めっきとは
めっき( plating )
鍍金(ときん)とも言われ,金属を中心とする材料に対し,材料の装飾,耐食性向上,耐摩耗性向上,表面硬さなどの表面機能付与を目的に,異種金属の薄膜被覆による表面処理やその方法を指す。
なお,めっきは,カタカナでメッキと表記される場合も多いが,日本語なので,ここではひらがな表記とする
めっきは,処理工程の違いで電解めっき(電気めっき: electro plating ),無電解めっき( electroless plating ,化学めっき :chemical plating ),溶融めっき( hot dip coating ),化成処理( chemical oxidation, chemical conversion )に分けられる。
ここでは,酸化還元反応の活用例として電解めっき(電気めっき)について順次紹介する。
備考:元来の鍍金は,金と水銀の合金(金アマルガム)を塗付け,加熱して水銀のみを気化させて得たものについていうが,現在はめっき全般をいう。
ページの先頭へ
電解めっき(電気めっき)原理
電解めっき
電気めっきとも呼ばれ,多くの分野で活用されている。電解めっきの原理は,前節で紹介した鉛電池の充電時と同様の酸化還元反応である。
電解めっきでは,下の原理図に示すように,陰極(カソード)に導電性のある対象物(商品)を取り付け,陽極(アノード)には,めっきの種類により反応に直接関与する場合は活性電極を,そうでない場合は不活性電極を用いる。
電解めっきに用いる電解液は,導電性付与に加えて,めっき目的に適した組成のめっき溶液が用いられる。めっき浴を電解槽に入れた状態のとき,これをめっき浴( plating bath )という。
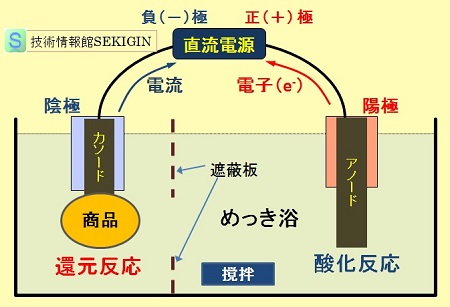
電解めっきの原理図
【参考】
JIS K 0213「分析化学用語(電気化学部門)」に定義される関連用語を紹介する。
電極( electrode )
広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう。)。狭義にはイオン伝導体に接触している電子伝導体の相。
活性電極( active electrode )
電極反応に直接関与して溶解又は析出するような電極。
不活性電極( inert electrode )
電極反応において,電子の授受だけに関与し,電極自身は化学変化を起こさない電極。
厳密な意味ではこのようなものは実在しないが,実用では白金黒電極,白金黒付き白金電極,黒鉛(炭素)などが用いられる。
ページの先頭へ
電解めっき条件
電気分解との大きな違い
電解液(めっき浴)中の電流分布やイオン濃度の均質化を行う工夫があること,電気分解で紹介したような水素など気体発生がめっき膜の品質に影響するので,気体発生のない電解めっき条件(めっき液の組成など)を採用するなどである。さらには,めっきを施す材料の表面の品質がめっきの品質に大きく影響する。
以下には,東京都鍍金工業組合のデーターベースを参考に,活性電極を用いるニッケルめっき,不活性電極を用いるクロムめっきをのめっき浴の組成やめっき条件を紹介する。
電解ニッケルめっき(ワット浴)
めっき浴組成:硫酸ニッケル( 240 ~ 350 g/L ),塩化ニッケル( 30 ~ 60 g/L ),ホウ酸( 30 ~45 mg/L ),添加剤(光沢付与など,適量)
めっき浴条件: pH 2.5 ~ 4.5 ,温度 40 ~ 65 ℃
陽極材料:目的に応じて,次に示す材質の小片を布製の袋(アノード袋)に詰めたものを用いる。
電解ニッケル:電解で得られた純度の高いニッケル板
高硫黄ニッケル:硫黄 0.01 ~ 0.02 %を含有する電解ニッケル板
カーボナイズド・ニッケル: 0.25 %程度の炭素を含むニッケル
電圧・電流密度: 2 ~ 6 V ,2 ~ 7 A/dm2 ( 1 dm2 = 10-2 m2 )
電解クロムめっき
めっき浴組成:無水クロム酸( 247.5 g/L ),硫酸イオン( 2.5 g/L )
めっき浴条件: pH ~ 1 ,温度 32 ~ 49 ℃
陽極材料:鉛-スズ( 7 %)合金
電圧・電流密度: 3 ~ 8 V ,2.5 ~ 20 A/dm2 ( 1 dm2 = 10-2 m2 )
ページの先頭へ