第三部:化学反応 電極反応
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電気化学の電極反応に関連し,【電極電位とは】, 【基準電極とは】, 【電位の測定】 に項目を分けて紹介する。
電極電位とは
電極電位( electrode potential )
JIS K 0213 「分析化学用語(電気化学部門)」では,
a ) 電極が溶液相などのイオン伝導体相と接しているとき,後者の内部電位に対する前者の内部電位。
注記:この値を直接実測することは不可能である。
b ) 注目している電極系を,ある参照電極と組み合わせてガルバニ電池を構成させたとき,注目する電極に取り付けた
金属端子の内部電位から,参照電極に取り付けた同種の金属端子の内部電位を差し引いた値。
と定義している。
すなわち,電極電位の絶対値を測定することは不可能で,知ることができるのは,基準とした電極(基準電極)との電位差である。
電極電位の把握と電極反応
ここで,電解液に金属を浸漬した場合の反応について,電解液種,金属種を変えた場合の実験結果を整理してみる。
1) 硫酸銅( CuSO4 )水溶液に,鉄( Fe )線を浸漬
Fe → Fe2+ + 2e- , Cu2+ + 2e- → Cu↓
の反応が起き,鉄が酸化され鉄イオンに,銅イオンが還元され鉄線の表面に銅が析出する。
2) 硝酸銀( AgNO3 )水溶液に,銅( Cu )線を浸漬
Cu → Cu2+ + 2e- , 2Ag+ + 2e- → 2Ag↓
の反応が起き,銅が酸化され銅イオンに,銀イオンが還元され,銅線の表面に銀が析出する。
3) それでは,硫酸銅水溶液に,銀線を入れてみよう。この場合に,次の反応が起きるだろうか?
2Ag → 2Ag+ + 2e- , Cu2+ + 2e- → Cu↓?
実際に行うと,何の変化も起きません。
この結果からは,金属と金属イオンの組み合わせで反応の方向が決まるのは何故か?という疑問が生まれる。
答えは,先に示した電池や局部電池の図で分かるように,電気回路が形成される原因を知ればよい。
言い換えれば,金属の酸化(負極,アノード)と金属イオンの還元(正極,カソード)の電位が負極 < 正極であれば電気回路が形成され反応は進むが,負極 ≧ 正極の場合には反応の進展は期待できないことが分かる。
すなわち,電極反応が進むか否かの判定に電極の電位の把握が重要である。
ページの先頭へ
基準電極とは
原理的には,限定されることなく,電極の選択は自由である。しかしながら,電極電位の絶対値を測定できないので,相互の比較を目的とするならば,だれがどこで用いても,同じ結果が得られる安定した基準となる電極が求められる。
このために,次の条件を満たす電極を基準電極( reference electrode )と定められた。
・可逆的反応でネルンストの式に従う。
・電位が安定で経時変化が無い。
・電流が流れても,その後直ちに平衡電位に回復する。
・温度サイクルに対し,電位ヒステリシスを示さない。
これらを満たす代表的な電極として,水素電極( Pt /H2 /HCl ),飽和カロメル電極( Hg /Hg2Cl2 /飽和KCl ),銀・塩化銀電極( Ag /AgCl /飽和KCl )などが開発されている。
水素電極( hydrogen electrode )
水素ガスの分圧 101.325 kPa ,水素イオンの活量 1 のとき,電極電位の基準として用いられる。全ての温度において,この電極の電位は IUPAC (国際純正・応用化学連合)の規約によって 0 V と定められ,標準水素電極( standard hydrogen electrode , SHE , normal hydrogen electrode , NHE )という。
25 ℃のときの飽和カロメル電極の電位(略号 SCE )は,0.2444 V vs. SHE で,銀・塩化銀電極の電位(略号 Ag /AgCl )は,0.196 V vs. SHE である。なお,vs SHE は,水素電極( 0 V )を基準とする電位を意味する。
従って,標準水素電極を基準とする電位 E ( SHE ) は,飽和カロメル電極の電位 E( SCE ),銀・塩化銀電極の電位 E( Ag/Agcl )との関係( 25 ℃)は次の通りである。
E ( SHE )= E ( SCE ) + 0.2444 = E ( Ag/AgCl ) + 0.196
ネルンストの式( Nernst equation )
酸化還元反応: ox + ze- ⇆ red
が平衡状態の時,基準電極(標準水素電極)との電位差 E (平衡電極電位)は,
E = E0 + ( RT /zF ) ln ([ox] /[red] )
の関係にある。
ここで,E0 :標準電極電位,R :気体定数( 8.314 JK-1mol-1 ),T :熱力学的温度( K ),
z :酸化還元反応にて授受される電子数,F :ファラデー定数( 96,485 C mol-1 ),ln :自然対数,
[ox] :酸化型の化合物の活量,[red] :還元型の化合物の活量である。
なお,25℃の時は,RT /F = 0.0592 となる。
【参考】
基準電極( reference electrode )
電極電位の測定において基準となる電位を与える電極で, 日本語では参照電極,照合電極ともいわれる。
参照電極,比較電極( reference electrode )
作用電極又は指示電極と組み合わせて電位を測定又は制御するために基準とする電極。( JIS K 0213 「分析化学用語(電気化学部門)」)
ヒステリシス( hysteresis )
その性質が,それ以前の履歴に依存するような系にみられる現象。強磁性体の磁化曲線に典型的な例が見られる。他に力学系の塑性変形,強誘電体の電気分極などにおいてもその存在が知られている。(科学大辞典)
ページの先頭へ
電位の測定
標準水素電極は,気体水素を用いる上に,取り扱い上の制約が多い。このため,一般的な電位測定の基準電極(参照電極)としては,取り扱いが容易で電位の安定している銀-塩化銀電極(0.119 V vs. SHE),又は飽和カロメロ電極(0.244 V vs. SHE)を用いる。
電極電位は,下図に示すように,参照電極(基準電極)をアノード反応の場とし,求めたい酸化還元反応(カソード反応)の電極(作用電極という)を配し,両電解質溶液をルギン管などの塩橋で結び,電池を組み立てたときの起電力から求める。
起電力は,原理図に示すように,直流電位差計を用いて,電流が流れない条件を探査し,この時の電極間の電位差を求めることで得られる。
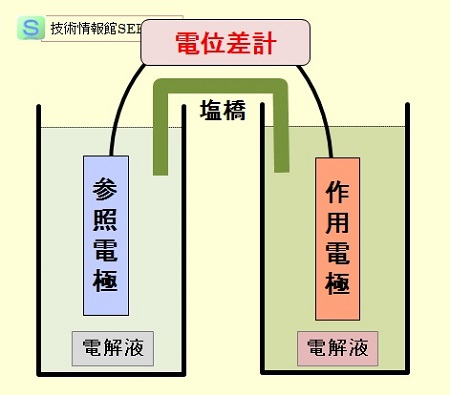
電極電位の測定原理
【参考】
ルギン管( Luggin capillary )
作用電極に接近して配置するために,先端を細いキャピラリーとした参照電極に接続された塩橋。( JIS K 0213 「分析化学用語(電気化学部門)」)
塩橋( salt bridge )
二つの電解質溶液の混合を防止して相互作用を減少させ,電気的な接触を得るために用いる電解質の溶液又はゲル。( JIS K 0213 「分析化学用語(電気化学部門)」)
作用電極( working electrode )
電極反応を行わせるための,少なくとも 2 本の電極のうち注目している反応が進行する電極。( JIS K 0213 「分析化学用語(電気化学部門)」)
ページの先頭へ