第三部:化学反応 電極反応
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電気化学を理解するため,基本となる 【電極反応とは】, 【電極反応の原理;電池を例に】, 【局部電池の形成】 に項目を分けて紹介する。
電極反応とは
電気化学( electrochemistry )
「化学変化に伴う電気的現象,又は電気の関与する化学変化について研究する化学の一部門。電池・電極反応・電離などの理論および応用を研究。」
と理解されている。具体的には前項までの【電池】,【電気分解】,及び【めっき】で紹介した電極表面で起きる化学的現象の研究分野をいう。
電極反応( electrode reaction )
広辞苑では,
「電極と電解質,又は電解質溶液との界面で進行する不均一系酸化還元反応。」と解説している。
JIS K 0213「分析化学用語(電気化学部門)」では,
「電極と電解質溶液,溶融塩などのイオン伝導体との間で起こる少なくとも一つの電荷移動過程,及びそれに伴って電極近傍で起こる物質移動,化学反応などの全ての過程。狭義には,電荷移動過程だけをいう。」と定義している。
すなわち,電極反応には,電極と電解質で構成される系,電極と電解質溶液で構成される 2つの系がある。問題(研究対象)とするのは,電解質,又は電解質溶液全体で均一に進む現象ではなく,電極との界面で生じる酸化還元反応,すなわち不均一系の反応である。
【基礎用語】
JIS K 0213「分析化学用語(電気化学部門)」における基礎用語の定義を紹介する。
電極( electrode )
広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。
電解質溶液( electrolytic solution )
電気伝導性をもつ溶液。イオン性物質を水などの極性溶媒に溶解して調製する。
支持電解質,支持塩( supporting electrolyte )
液体の導電性を高めるために添加する物質。
電気伝導率,導電率(溶液の)( electric conductivity , conductivity (of solution) )
溶液がもつ抵抗率の逆数で,電極間距離を電極表面積と電気抵抗との積で除した値。SI 単位は S/m(ジーメンス/メートル)。
注記 電気伝導率,電気伝導度及び測定セルのセル定数は,次の式で示す関係にある。
L=J×LX
ここに,L:測定試料の電気伝導率(S/m),J:セル定数( m-1 ),LX:測定した電気伝導度(S)
ページの先頭へ
電極反応の原理:電池を例に
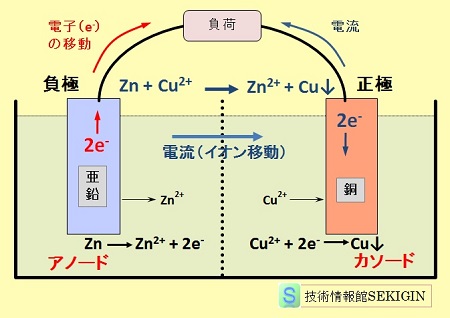
例として,下図にダニエル電池の原理図を示す。
この電池では,負極(-極,アノード,陰極)である亜鉛電極の表面で亜鉛の酸化反応(アノード反応)が起きる。
Zn → Zn2+ + 2e-
この反応で生成した亜鉛イオンは電解液中に拡散し,電子が亜鉛電極の表面に残される。
この結果として,正極(+極,カソード,陽極)である銅電極と亜鉛電極との間に電子の密度に差が生じる。この差の解消のため,導線を通じての電子が移動(押し出し)する。同時に,銅電極の表面において,酸化反応で生成した電子数と同数の電子が溶液中の銅イオンの還元反応(カソード反応)で消費される。
Cu2+ + 2e- → Cu
異なる場所にある電極表面で酸化反応と還元反応が,ほぼ同時に,連続的に起きるためには,銅電極 → 導線 → 亜鉛電極 → 電解質溶液 → 銅電極の電気回路の形成が不可欠である。
従って,継続した反応の進行では,電解質溶液中でのイオンの移動(微小移動)による電流の保持が求められる。
電解質溶液中中のイオン量が低い場合には,電解質溶液の導電性(導電率)の低さが抵抗となり電圧降下により電流の低下,すなわち酸化還元反応に関わるイオン量の減少,反応速度の低下に至る。
電圧降下の影響を排除するため,すなわち,電解質溶液の導電率を高くすることを目的とし,支持電解質(支持塩: supporting electrolyte )といわれる酸化還元反応に関わらない電解質を添加することがある。
なお,上述の異なる金属の接触で生じる電極反応は,複数種の金属材料で構成される構造物や機械類における異種金属接触腐食( bimetallic corrosion, galvanic corrosion )の原因として,身近で経験されている。
ダニエル電池の原理図
ページの先頭へ
局部電池の形成
上述のダニエル電池を例に紹介した電極反応は,種類の異なる金属を導線で接続した場合であった。
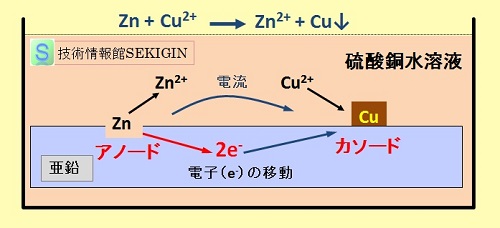
単一の金属表面でも同様の電極反応が発生する。例えば,硫酸銅水溶液に亜鉛板を浸漬した場合に,亜鉛板表面の汚れ,付着物などを原因とした不均一(ポテンシャルエネルギー差)を原因として,亜鉛板表面に金属亜鉛の酸化される部分(アノード)と銅イオンが還元される部分(カソード)が形成される。
このようにして形成された電池を局部電池( local cell )という。
この例では,アノードでの酸化反応で生成した電子は,亜鉛板に残され,亜鉛板のカソードとなる部分で電解液中の銅イオンの還元に消費され,亜鉛の表面に金属銅が析出する。一旦,金属銅が付着すると,前述の電池と同じ機構で電極反応が継続する。この現象は,“置換めっき”ともよばれる特殊な例である。
局部電池の模式図(置換めっき)
JIS K 0213 「分析化学用語(電気化学部門)」では,局部電池を
「電解質溶液中に浸した金属単体,合金などに局部的な電位差が生じ,金属表面の局部で電流が流れることで形成される電池。金属腐食の原因の一つとなる。」
と定義している。
より一般的な局部電池の例としては,金属の腐食などで観察される。
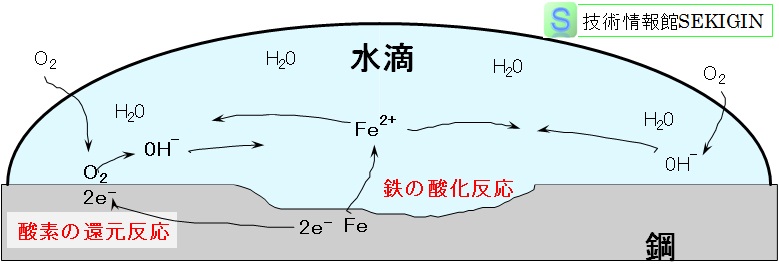
すなわち,濡れた鋼などの金属の全面腐食(均一腐食; general corrosion , uniform corrosion )は,局部電池の形成が原因である。
金属の全面腐食では,何らかの原因で金属の表面に酸化反応するアノード部と還元反応するカソード部が形成され,電池の場合と同様に金属表面カソード部 → 電解液 → 金属表面アノード部 → 金属内部 → 金属表面カソード部の間で電気回路が形成されることで反応が継続する。
金属表面の水滴中での腐食反応模式図
ページの先頭へ