第三部:化学反応 化学反応とエネルギー
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,化学反応とエネルギーに関連し, 【結合エネルギーとは】, 【反応熱と結合エネルギー】 に項目を分けて紹介する。
結合エネルギーとは
【化学反応とは】で紹介したように,熱化学反応式では,反応熱(モルエンタルピー変化量)を添えて表記される。
また,【反応熱とは】で紹介したように,化学反応の反応熱( heat of reaction )は,反応前の関連化学物質の結合エネルギーの総和と反応後の物質の結合エネルギーの総和の差であることを紹介した。
従って,関連する物質個々の結合エネルギーが既知の場合は,結合エネルギーの差を計算することで,未知の化学反応の反応熱を求めることができる。
結合エネルギー( free energy )
分子や結晶の状態とそれらを構成する原子がばらばらに存在する状態との間でのポテンシャルエネルギーの差をいう。
すなわち,分子の持つ全結合を切断するためのエネルギーの総和である。分子中の結合を一つ一つ切断するのためのエネルギーを結合解離エネルギー( bond dissociation energy )という。
結合エネルギーという場合は,本来の意味である分子の結合解離エネルギーの総和をいう場合と,分子中の同種の結合に関する結合解離エネルギーの平均値を用いて分子中の一つの結合についていう場合がある。
二原子分子の結合エネルギーは,分子の解離熱から直接求めることができる。 例えば,気体の標準状態( 0 ℃ 1 気圧)で解離するときの解離熱から,の水素分子( H – H )の結合エネルギー 432.0686 kJ / mol ,酸素分子( O = O )の結合エネルギー493.6 kJ / mol が得られる。
多原子分子では,分子全体の解離熱は求められるが,個々の結合解離エネルギーを単純に決めることができない。このため,解離熱から既知の結合解離エネルギーの値を引いて,未知の結合解離エネルギーを求める方法が用いられる。
一方,また,同等の結合をもつ多原子分子では,各結合解離エネルギーの平均をその分子の結合エネルギーとする場合もある。
結合解離エネルギーの例
結合エネルギーは,解離熱を計測して求めるので,測定方法・精度の向上に伴い値が改訂される。ここでは,2004年発行の化学便覧(第五版)から抜粋して紹介する。
| 結合種 | 結合解離エネルギー D | 結合種 | 結合解離エネルギー D |
|---|---|---|---|
| H-H(H2) | 432.0686 | N-N(N2) | 941.6 |
| H-OH(H2O) | 492.15 | O-O(O2) | 493.6 |
| H-O(H2O) | 426.1 | O-CO(CO2) | 526.1 |
| H-Cl(HCl) | 427.7 | O-C(CO2) | 1071.8 |
| H-CH3 | 431.8 | C-C(C2H6) | 366.4 |
| H-CH2CH3 | 414 | C-C(C2H4) | 714 |
| H-OCH3 | 435.1 | C-C(C2H2) | 956.6 |
ページの先頭へ
反応熱と結合エネルギー
水素と酸素から水が生成する反応の熱化学方程式は,化学便覧( 25 ℃ 1 気圧)に
2H2 ( g ) + O2 ( g ) → 2H2O ( l ) ΔfH0 = -285.83 kJ /mol
ΔfH0 :反応熱(標準生成エンタルピー変化)
と記述されている。
この反応式を用いて,化学便覧から得られる結合解離エネルギー( 0 ℃ 1 気圧)などのデーターから,反応物と生成物のエネルギー差を求めてみる。
反応物( H2 ( g ) + 1/2 O2 ( g ) )の結合エネルギーの総和は,便覧に掲載されている
H - H の結合解離エネルギー 432.0686 kJ /mol
O = O の結合解離エネルギー 493.6 kJ /mol
の値を用いて,678.8686 kJ /mol(= 432.0686 + 493.6/2 )と計算される。
熱化学方程式の生成物は液体なので,H2O ( g ) の結合解離エネルギーに加えて,気体から液体{ H2O ( g ) → H2O ( l ) }への凝集熱が加わる。
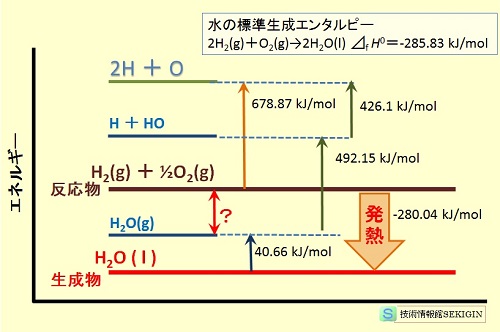
水の反応熱と結合エネルギー
従って,生成物{ H2O ( l )}の持つエネルギーは,
H - OH の結合解離エネルギー 492.15 kJ /mol
H - O の結合解離エネルギー 426.1 kJ /mol
の和 918.25 kJ /mol に,
凝集熱 40.66 kJ /mol
を加えた総和 958.91 kJ /mol となる。
従って,反応物と生成物のエネルギー差は,678.8686 - 958.91 = - 280.0414 kJ /mol (発熱)となる。
温度条件の異なる結合解離エネルギーから求めたエネルギー差( - 280.0414 kJ /mol )と,標準生成エンタルピー( - 285.83 kJ /mol )とに差異はみられるが,既知の文献から得られるデータを用いても,未知の化学反応の傾向(発熱,吸熱の程度)を予測するのに十分な情報が得られる。
ページの先頭へ