第三部:化学反応 電気化学
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電気化学の基礎として,金属の陽イオンへのなり易さの定義の違いに関連し, 【イオン化尺度の比較】, 【電極電位と環境】 に項目を分けて紹介する。
イオン化尺度の比較
前述の三種類のイオン化の尺度(原子の陽イオンになり易さ)について,実用の多い金属元素について比較した。
【イオン化エネルギー】(ionization energy)
気体状態の単原子(又は基底状態の分子)から原子やイオンなどから電子を取り去るのに要するエネルギー,すなわち,取りだされた電子の結びつきの強さの目安で,エネルギーが小さいほど陽イオンになり易く,陽性が強いという。
【電気陰性度】( electronegativity )
化学結合にあずかる電子(共有電子対)を引き寄せる力の強弱を表す尺度である。一般的には,電気陰性度の小さい元素は,陽性が強く(陽イオンになり易い),大きい元素は,陰性が強い(陰イオンになり易い)と考えてよい。
【酸化還元電位】(redox potential)
水溶液中など酸化還元反応が起きる場(反応系)での電子授受で発生する電極電位を酸化還元電位という。 酸化還元電位は,規定する条件下において,反応にあずかる物質の電子の放出しやすさ,又は受け取りやすさを定量的に評価する尺度となる。
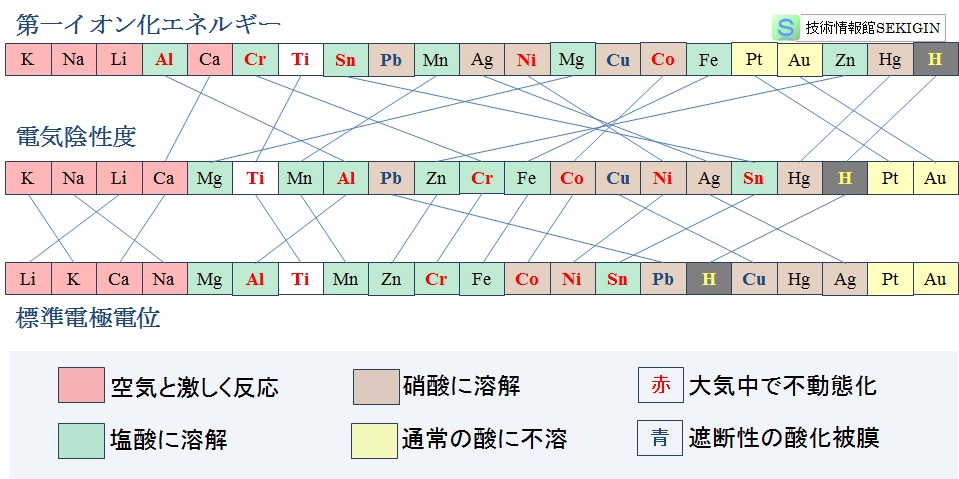
大気・水溶液中の反応性とイオン化傾向の比較
ページの先頭へ
電極電位と環境
標準酸化還元電位(標準電極電位)は,標準状態の酸化還元電位を熱力学的に求めた値である。
実際には金属表面に付着する酸化物や不動態被膜の特性が大きく寄与し,使用環境によっては金属の順列が容易に入れ替わる。
例えば,海水中で計測した電極電位(自然電位)と標準電極電位を比較した図を示す。
図から分かるように,アルミニウムと亜鉛の順列が変わり,アルミニウムは亜鉛より海水中でイオン化し難くなる。
チタンは,劇的に変化し,水素よりイオン化し難い順列となり,海水中では貴金属のごとくイオン化されない金属になる。この耐食性と生体細胞との親和性から心臓ペースメーカーの部品や歯科のインプラント材料として用いられている。
このように,実用材料の選定などでは,使用予定の環境でのイオン化傾向を知るため,環境を模擬した条件での電極電位計測が求められる。
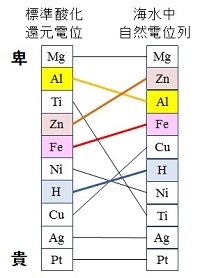
電極電位の比較
ページの先頭へ