第三部:化学反応 酸・塩基反応
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,酸・塩基反応を利用した代表的な化学分析法の 【酸・塩基滴定(中和滴定)とは】, 【酸・塩基滴定の基本操作】 に項目を分けて紹介する。
酸・塩基滴定(中和滴定)とは
アレニウス酸・塩基の反応は,前項の【酸・塩基の反応】で紹介したように,中間過程を省略し,最初と最後の状態(塩と水)を示す式
HX + YOH → XY (aq) + H2O
で表記するのが通例である。
しかし,実際には,難溶性塩が生成される反応以外では,水溶液中で安定な陽イオン水和物( Y+ (aq) )と陰イオン水和物( X-(aq) )として存在する。
従って,当量の酸と塩基(アルカリ)を混ぜた場合は,最終生成物の塩を水に溶解した状態になる。
一方で,酸と塩基が異なる量で混合した場合には,陽イオンと陰イオンの比率,すなわちヒドロニウムイオン( H3O+ )と水酸化物イオン( OH- )の量的な関係はどうなっているのだろうか?
これを理解するには,一方の物質量を徐々に変えながら pH 変化を観察するのが早道である。ある量の塩基水溶液に対し,徐々に加えた酸の量を横軸に採り,その時の pH を縦軸にとって得られる図を滴定曲線( titration curve )という。
滴定曲線を用いて,酸水溶液や塩基水溶液に含まれる物質量を求める化学分析方法( chemical analysis )を酸塩基滴定法( acid-base titration )という。
酸塩基滴定法は,中和滴定法( neutralization titration )とも言われ,滴定による定量分析法の一種である。なお,酸を用いた滴定を酸滴定(acidimetry),アルカリを用いた滴定はアルカリ滴定(alkalimetry)という。
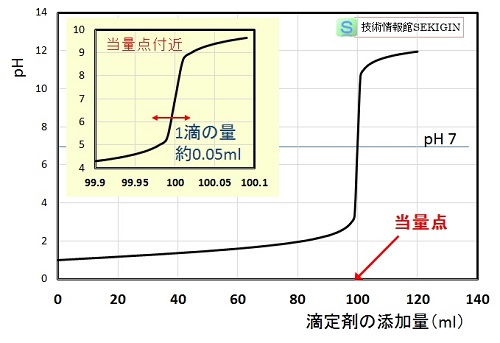
滴定曲線(例)
強酸水溶液( 0.1 mol /L ,100ml )を強塩基(0.1 mol /L)水溶液で滴定
【参考】
定量分析法( quantitative analysis )
化学反応を用いて化学物質量を測定する操作を定量分析法といい,原理の違いから重量分析,容量分析,光分析,電気分析などに分けられる。 この中で,滴定操作によって対象物質と定量的に反応する滴定液の体積を求め,その値から物質を定量する方法を容量分析( volumetric analysis )という。
滴定( titration )
試料溶液に含まれる分析種に対し,これと反応する試薬(滴定剤という。)として,濃度既知の標準液を用いるか,又は滴定剤を電気化学的に発生させて,化学量論的な反応終点までに要した標準液の量,又は電気量から分析種を定量する操作。【 JIS K 0211「分析化学用語(基礎部門)」】
滴定法( titrimetry )
試料溶液に含まれている分析種に対し,これと反応する試薬(滴定剤という)として,濃度既知の標準液を用いるか又は滴定剤を電気化学的に発生させて,化学量論的な反応終点までに要した標準液の量又は電気量から分析種を定量する方法。【 JIS K 0211「分析化学用語(基礎部門)」】
滴定曲線( titration curve )
横軸に滴定剤の量を,縦軸に被滴定剤の濃度又はそれに対応する量をとり,図示した曲線。【 JIS K 0211「分析化学用語(基礎部門)」】
JIS K 0050 : 2011 「化学分析方法通則: General rules for chemical analysis 」
容量分析
容量分析は,滴定操作によって分析種の全量と定量的に反応する滴定液(滴定用溶液ともいう。)の体積を求め,その値から分析種を定量する方法である。
滴定は,化学反応の種類によって 4 種類に区分し,その概要は,次による。(以下省略)
a) 中和滴定(酸塩基滴定): 酸と塩基との中和反応を利用する滴定によって定量する方法
b) 酸化還元滴定:酸化還元反応を利用する滴定によって定量する方法
c) 錯滴定:錯体の生成又は分解反応を利用する滴定によって定量する方法
d) 沈殿滴定:沈殿の生成又は消滅を利用する滴定によって定量する方法
その他の一般に用いられる滴定法の名称
温度滴定法(thermometric analysis ),カールフィッシャー滴定法( Karl Fischer titration method ),
キレート滴定法( chelatometric titration ),逆滴定法(back titration ),
光度滴定法( photometric titration ),コロイド滴定法( colloidal titration ),
錯滴定法( complexometric titration ),酸化還元滴定法( oxidation-reduction ; redox titration ),
濁度滴定法( turbidimetric titration ),置換滴定法( displacement titration ),
沈殿滴定法( precipitation titration ),電位差滴定法( potentiometric titration ),
電流滴定法( amperometric titration ),電量滴定法( coulometric titration ),
非水溶媒滴定法(nonaqueous titration ),よう素滴定法( iodimetry ; iodometry )
ページの先頭へ
酸・塩基滴定の基本操作
酸塩基滴定(中和滴定)の具体的な例は,【中和滴定の実例】で紹介し,ここでは,分析操作の基本的な流れを紹介する。
試験手順
(1) 試料溶液に pH 変化を検出できる指示薬( indicator )を加える。または,pH をモニターできる検出機器を用意する。指示薬は分析対象イオンと滴定剤との滴定曲線の特徴から適切な化合物を選択しなければならない。
(2) 分析対象の物質(陽イオン,又は陰イオン)と反応し,当量点での pH 変化が大きい滴定剤(物質と濃度)を準備する。
(3) 滴定剤を滴下できる器具(ビュレットなど)を用いて,慎重に滴下し終点( end point )を的確に判別する。
試験結果の整理
求めたい値は,分析対象物の全量と定量的に反応するのに必要な量,すなわち当量点( equivalence point )であるが,分析操作で観察できるのは終点である。
終点は必ずしも当量点と一致しない(終点誤差という)ことを理解したうえで,実験結果を整理しなければならない。
なお,一般には,終点や当量点を中和点と称する慣例がある。中和点の用語を用いた時に,終点や当量点が中性( pH 7 )になる点と誤解されないよう表現に注意が必要である。
【参考】
指示薬( indicator )
試料の化学的状態をできるだけ明確に示す性質をもつ物質。【 JIS K 0211「分析化学用語(基礎部門)」】
当量点(滴定の)( equivalence point )
滴定において,試料溶液に含まれている分析種に対し,これと反応する試薬(滴定剤という。)を分析種の全量と定量的に反応するのに必要な量だけ加えた点。【 JIS K 0211「分析化学用語(基礎部門)」】
終点(滴定の)( end point )
滴定すべき反応が終わったことを指示薬,又は反応検出器で認められる点。【 JIS K 0211「分析化学用語(基礎部門)」】
終点補正(滴定の)( end point correction )
終点と当量点との差の補正。【 JIS K 0211「分析化学用語(基礎部門)」】
終点誤差( end - point error )
当量点と実際の滴定終点との差。【 JIS K 0211「分析化学用語(基礎部門)」】
ページの先頭へ