第三部:化学反応 酸・塩基反応
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,酸・塩基反応を利用した化学分析法(中和滴定)の基本を, 【強酸を強塩基で滴定】, 【滴定曲線】, 【参考:滴定指示薬と変色域】 に項目を分けて紹介する。
強酸を強塩基で滴定
酸・塩基反応の組み合わせは, 電離平衡の異なる 1価の酸・塩基,多価の酸・塩基,強酸と強塩基,弱酸と強塩基,強塩基と弱塩基,弱酸と弱塩基など様々である。
1価の強酸を 1価の強塩基で滴定(イオン濃度と pH変化)
1 価の強酸(塩酸など)の水溶液を 1 価の強塩基(水酸化ナトリウムなど)の水溶液で滴定する場合を考える。
1 価の強酸と強塩基は,解離定数が著しく大きいので,完全に電離しているものと仮定できる。
強酸の水溶液 : HX + 2H2O → X- (aq) + H3O+
強塩基の水溶液 : YOH + 2H2O → Y+ (aq) + OH-
この状態で,滴定の操作を続けた場合の酸,塩基の濃度変化,水溶液の pH 変化を考えることになる。水溶液の pH は,【強酸・強塩基の pH 】で紹介したように,水の自己解離定数,物質収支,電気的中性原理から求めることができる。
① 水の自己解離定
2H2O ⇆ H3O+ + OH-
KW = [ H3O+ ] [ OH- ] = 1.0×10-14 式 1)
② 物質収支
試験液中の酸はすべてイオン化しているので,イオンの絶対量は変化しないが,滴定操作による試験液の容量が増加する。従って,試験液中のイオンのモル濃度 [ X- ] が変化する。
そこで,滴定前の酸の初期モル濃度 CA0(知りたい値),容量 VA とし,塩基水溶液(滴定剤)の添加容量を VB とすると,試験液中の酸のモル濃度は,
[ X- ] = CA0・VA/( VA + VB ) 式 2)
となる。
一方,強塩基を用いているので,加えた塩基もすべて電離する。従って,試験液中の塩基イオンのモル濃度 [ Y+ ] は,滴定に用いる溶液(滴定剤)の初期モル濃度 CB0 (既知濃度)とすると,
[ Y+ ] = CB0 VB/( VA + VB ) 式 3)
となる。
③ 電気的中性原理
[ H3O+ ] + [ Y+ ] = [ X- ] + [ OH- ] 式 4)
④ 滴定剤の量と pH の関係
式 1)と式 4 )から [ H3O+ ] に関してまとめると
KW = [ H3O+ ] [ OH- ] = [ H3O+ ] ・〔 [ H3O+ ] + [ Y+ ] - [ X- ] 〕
∴ [ H3O+ ] 2 + [ H3O+ ] ( [ Y+ ] - [ X- ] ) - KW = 0
となる。この二次方程式の正の解は,
[ H3O+ ] = { -[ Y+ ] + [ X- ] +〔 ( [ Y+ ] - [ X- ] ) 2 + 4KW 〕 1/2 }/2 式 5)
となり,試験液の pH ( = -log [ H3O+ ] ) は,陽イオン濃度(式 3)),陰イオン濃度(式 2))の関数として得られる。
ページの先頭へ
滴定曲線
濃度 CA0 ,CB0 ,及び容量 VA は,滴定操作を進めても変化しない値である。一方,滴定操作で変化する値は,VB となる。
従って,横軸に添加した塩基の容量 ( VB ) ,縦軸に溶液の pH をとると,下図の曲線(滴定曲線)が得られる。
滴定が進み,当量点 [ Y+ ] = CA に近づくと pH の急激な変化が起こり,当量点のpHは,
pH = - log10{ - [ Y+ ] + CA +〔 ( [ Y+ ] - CA ) 2 + 4KW 〕1/2 }/2 = - log10 ( KW )1/2 = 7
となる。
この時の,滴定剤の添加量と塩基のモル濃度から,未知の酸の初期濃度は,
CA0 VA /( VA + VB ) = CB0 VB /( VA + VB )
∴ CA0 = CB0 VB /VA
で求められる。
下図の滴定曲線から分かるように,強酸を強塩基で滴定した場合には,当量点前後で,滴定剤 1 滴にも満たない量( 0.05 ml 以下)で急激なpH 変化を示す。
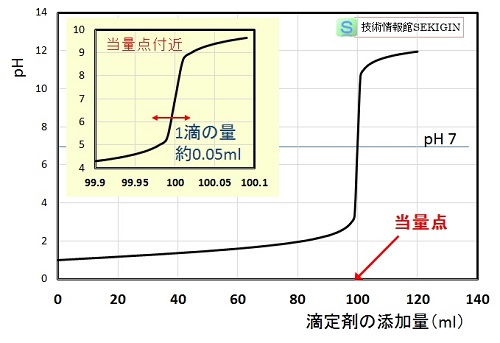
滴定曲線
強酸水溶液( 0.1 mol /L ,100ml )を強塩基(0.1 mol /L)水溶液で滴定
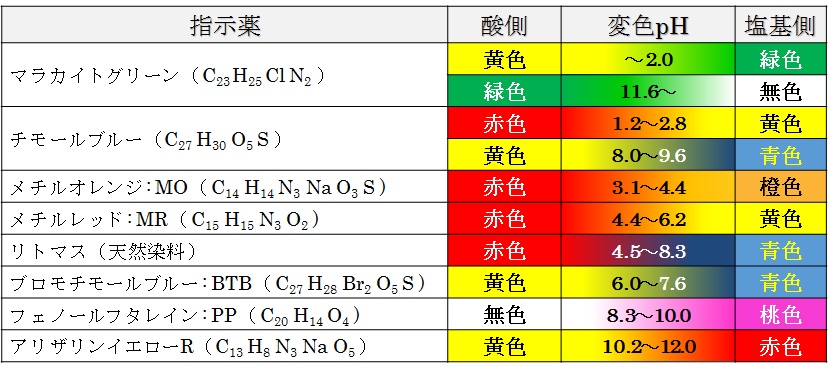
例えば,pH 8 以上で無色 → 赤色に変わるフェノールフタレンを指示薬として用いると,当量点を僅かに超えた時点が終点となる。一方,pH 4 以上で赤色 → 黄色 に変わるメチルレッドを用いると,当量点直前が終点となる。
このように,厳密には,滴定の終点と当量点とは一致しない(終点誤差)ので,より正確な測定を行う場合は,用いた終点検出法に適した終点補正が必要になる。
ページの先頭へ
参考:主な指示薬と変色域( pH 範囲)
ページの先頭へ