第三部:化学反応 電気化学
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,電気化学を理解するため,電極反応の具体例として, 【電気分解とは】, 【鉛蓄電池の電気分解(充電)】, 【主な電気分解事例】 に項目を分けて紹介する。
電気分解とは
電気分解( Electrolysis )
略して電解ともいわれ,二次電池(蓄電池)の充電操作で代表されるように,自然に放置したのでは進まない酸化還元反応を外部からエネルギー(電圧)を与えることで強制的に酸化還元反応を進めて,化合物を分解する方法である。
なお,電気分解における電流量と物質量については,【起電力と電気量】での解説と同様に考えることができる。
【参考】
JIS K 0213「分析化学用語(電気化学部門)」に定義される関連用語を紹介する。
電極( electrode )
広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。
活性電極( active electrode )
電極反応に直接関与して溶解又は析出するような電極。
不活性電極( inert electrode )
電極反応において,電子の授受だけに関与し,電極自身は化学変化を起こさない電極。
厳密な意味ではこのようなものは実在しない。
白金黒電極,白金黒付き白金電極( platinum black electrode , platinized platinum electrode )
白金上に更に白金をめっきした電極。
【参考:電極の名称】
● 電気分解の陽極と陰極
電気活性物質から電子を受け取る電極を陽極という。負極・アノードとなる。
電気活性物質へ電子を与える電極を陰極という。正極・カソードとなる。
電池の陽極・陰極とは反対の関係になっているので,注意が必要である。
● 正極( positive electrode , cathode )と負極 ( negative electrode , anode )
電池において,その放電時に外部回路から電子が流れ込む,又は外部回路に向かって正電荷が流れ出す電極を正極 といい,
電池において,その放電時に外部回路から正電荷が流れ込む,又は外部回路に向かって電子が流れ出す電極を負極 という。
● カソード( cathode )とアノード( anode )
還元反応を生じる電極をカソードといい,
酸化反応を生じる電極をアノードという。
ページの先頭へ
鉛蓄電池の電気分解(充電)
鉛蓄電池
鉛蓄電池( lead-acid battery )は,前項の【電池】で紹介したように,硫酸水溶液( 30~35%)を電解液として用い,鉛の格子に二酸化鉛( PbO2 )を充填した正極(+極),鉛の格子に海綿状の金属鉛を充填した負極(-極)とする起電力約 2 V の充電可能な二次電池(蓄電池)である。
電池の放電時には次の酸化還元反応が起こる。
PbO2(S) + Pb(S) + 2H2SO4 → 2PbSO4(S) + 2H2O
半反応式
金属鉛表面(酸化反応) : Pb(S) + SO42- → PbSO4(S) + 2e-
酸化鉛表面(還元反応) : PbO2(S) + 4H+ + SO42- + 2e- → PbSO4(S) + 2H2O
なお,Pb(s)の(s)は固体状態を意味する。
充電(電気分解)
鉛電池は,二次電池なので,酸化反応と還元反応が進み,硫酸濃度が低下すると有効な電気量が得られなくなる。この場合には,充電操作で性能の回復が可能である。
充電とは,外部の直流電源から電圧をかけ,放電で減少した電池活性物質を回復する操作で,放電時とは逆方向の酸化還元反応を強制的に実施することである。
2PbSO4(S) + 2H2O → PbO2(S) + Pb(S) + 2H2SO4
半反応式
金属鉛表面(還元反応) : PbSO4(S) + 2e- → Pb(S) + SO42-
酸化鉛表面(酸化反応) : PbSO4(S) + 2H2O → PbO2(S) + 4H+ + SO42- + 2e-
すなわち,外部電源の正極に結んだ電極で酸化反応により,硫酸鉛を酸化鉛と硫酸に,負極に結んだ電極で還元反応により,硫酸鉛を金属鉛と硫酸イオンに分解する反応を起こしている。
充電時の様子を下図に示す。電池の電極は,JIS K 0213 の定義に従うと,酸化反応の起きる酸化鉛の電極がアノードとなる。アノードから電子が外部回路に向かって流出するので負極である。放電時とは異なり,電気活性物質( PbSO4 )から電子を受け取るので陽極となる。
一方,還元反応の生じる金属鉛の電極がカソードとなり,外部回路から電子が流入するので正極であり,電気活性物質( PbSO4 )に電子を与えているので陰極となる。
すなわち,電気分解では,外部の直流電源の正極と結んだ電極(陽極)で酸化反応が起こり,負極と結んだ電極(陰極)で還元反応が起こる。
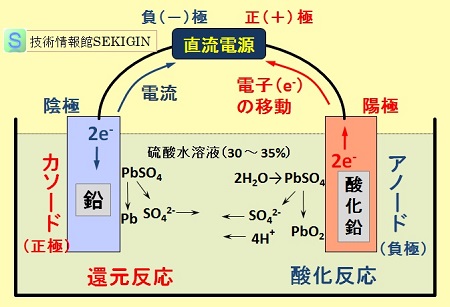
鉛電池・充電(電気分解)【模式図】
【参考:蓄電池の放電】
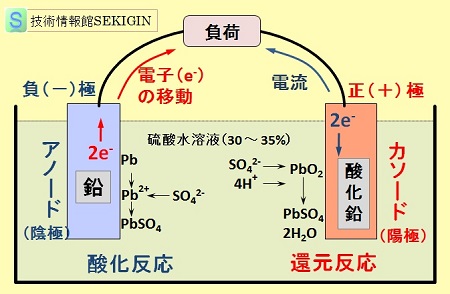
鉛電池・放電【模式図】
ページの先頭へ
主な電気分解事例
電気分解には,鉛電池の例のように,反応に直接関与する電極(活性電極,可溶性電極ともいう)を用いる場合,電子授受の場を提供するのみで,自身が反応に関与しない白金や炭素(黒鉛)でできた電極(不活性電極)を用いる場合に分けられる。
活性電極( active electrode )
次項で紹介する“電解めっき”などで用いられる。電解めっきでは,陽極にめっきしたい物質を電極として用い,陽極の電気分解で生成したイオン化合物を陰極表面で還元することで付着(めっき)させる場合などに活用される。
不活性電極( inert electrode )
以下で例示すように,溶液成分の電気分解を目的にする場合に,その成分との反応が起きないように適切に選択された材料を用いた電極である。一般的には,炭素(黒鉛)電極や白金黒電極が用いられる。
不活性電極を用いる電気分解の例
塩化銅(Ⅱ)水溶液の電気分解
陽極(酸化反応): 2Cl- → Cl2↑+ 2e-
陰極(還元反応): Cu2+ + 2e- → Cu↓
陽極(炭素電極)から塩素ガスが発生し,陰極上に金属銅が析出する。
硫酸銅(Ⅱ)水溶液の電気分解
陽極(酸化反応): 2H2O → O2↑+ 4H+ + 4e-
陰極(還元反応): 2Cu2+ + 4e- → 2Cu↓
陽極(白金電極)から酸素ガスが発生し,陰極上に金属銅が析出する。
疑問:陰イオンが塩化物イオンの場合と硫酸イオンの場合で,陰極から発生するガスが異なるのか?
⇒ 塩化物イオン,硫酸イオン,水の酸化還元電位の違い。
塩化ナトリウム水溶液の電気分解
陽極(酸化反応): 2Cl- → Cl2↑+ 2e-
陰極(還元反応): 2H2O + 2e- → H2↑+ 2OH-
陽極(炭素電極)から塩素ガスが発生し,陰極から水素ガスが発生する。
硫酸ナトリウム水溶液の電気分解(水の電気分解)
陽極(酸化反応): 2H2O → O2↑+ 4H+ + 4e-
陰極(還元反応): 4H2O + 4e- → 2H2↑+ 4OH-
陽極(白金電極)から酸素ガスが発生し,陰極から水素ガスが発生する。
疑問:陰極でナトリウムイオンが還元されず,水素が発生するのはなぜか?
⇒ 【標準酸化還元電位】で紹介するように,ナトリウムは水分子中の水素よりイオン化傾向が大きいためである。
原理的には,標準電極電位が水素の電位より負のリチウム,カリウム,カルシウム,マグネシウム,アルミニウムなどのイオンを含む水溶液の電気分解では,金属のイオンは還元されず,水の還元で水素が発生する。
ページの先頭へ