防食概論:防食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “防食概論(防食の基礎)” ⇒
構造対策
酸素除去
水と同様に,金属の腐食反応(corrosion reaction)に関わる酸素(oxygen)濃度を制御することで,鋼腐食の反応量を抑制できる。図には,鋼に接触する水に含まれる溶存酸素(dissolved oxygen)と鋼腐食の関係を示した。
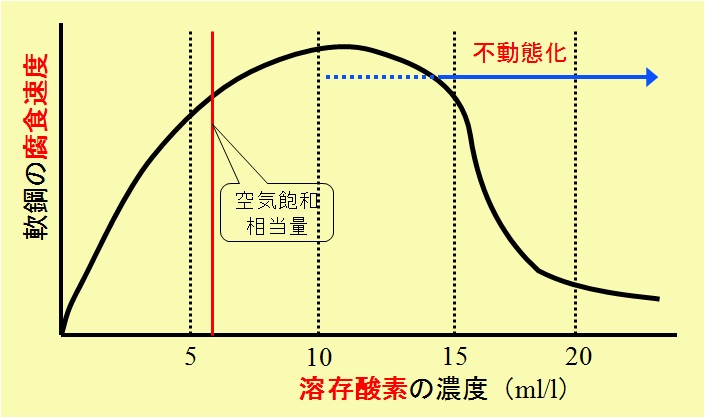
鋼腐食度に与える溶存酸素の影響
実用的には,酸素を添加するより除去する方が容易である。酸素を除去する方法として,脱酸素剤(deoxidant , deoxidating agent, oxigen scavebger)を用いる方法,腐食反応に関わらない不活性ガス(inert gas)で置換(除湿も兼ねる)する方法がある,化学プラントなどでは,不活性ガスによる置換が実用されている。
淡水環境では,脱酸素剤として亜硫酸ナトリウムやヒドラジンを用いて水溶液中の溶存酸素を除去できる。
注:点検等で検査員が出入りする状況では,酸欠事故に留意する必要がある。
【参考】
溶存酸素(dissolved oxygen)
DOと略称され,水中に溶解している酸素の量を意味し,一般的には水の汚染の程度を示す指標として用いられる。海洋や河川では,4~5mg/L を下回ると水中生物の生命が脅かされるといわれている。
酸素の溶解量は水温,溶解塩類の濃度,気圧などにより影響を受ける。ちなみに,1気圧の蒸留水の飽和溶存酸素量は,20℃で 8.84mg/L ,25℃で 811mg/L ,30℃で 7.53mg/L である。
酸素拡散律速(diffusion-controlled process of oxygen)
水の関与する金属腐食では,酸化反応が起きる場所と還元反応の場所が異なる。例えば,鉄の腐食では,鉄の酸化反応とそれに対応する酸素の還元反応が鉄表面の異なる場所で起きる。
この時,鉄の酸化反応と酸素の還元反応の結果で生じる鉄イオンの生成速度ν[Fe2+]は,反応速度論に従うと,反応物質の活量の積に比例する。すなわち,鉄表面の酸素濃度に比例する。また,鉄の酸化還元の反応速度は,静止する水中での酸素移動速度(拡散速度)より著しく大きいので,鋼表面に到達した酸素は,直ちに還元される。
結果として,鉄イオンの生成速度は,鋼表面に到達する酸素の量,すなわち酸素の拡散束(流束)に依存し,酸化還元反応の速度定数には依存しないことになる。この現象を,一般的には酸素拡散律速の腐食といっている。
不動態(passive state)
これまでの文献等では,用語として不働態を用いていたが,現在は,JIS 用語を含め,不動態を用いる例が多い。
標準電位列で卑な金属であるにもかかわらず,電気化学的に貴な金属であるような挙動を示す状態。【JIS Z0103「防せい防食用語」】
本来,ひ(卑)である電極電位を示し,不安定であるべき金属があたかも貴である金属のように振る舞う状態。この状態では,電極電位も貴の値を示す場合が多い。【JIS H 0201「アルミニウム表面処理用語」】
一般的には,金属をとり囲む環境の影響で,電気化学列で卑な金属(腐食しやすい金属)が,表面を酸化物で覆われるなどして本来の活性を失い,貴な金属のように挙動する状態を不動態といい,この状態になることを不動態化(passivity)と理解されている。
不動態化は,酸化力のある酸にさらされた場合,陽極酸化処理によっても生じる。不動態となる酸化被膜(不動態被膜)の典型的な厚みは,数 nm である。
すべての金属が不動態となるわけではなく,不動態になりやすいのは,アルミニウム,クロム,チタンなどやその合金である。
ページのトップへ