防食概論:防食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “防食概論(防食の基礎)” ⇒
電気防食
電気防食とは
金属の腐食現象は,【腐食概論】・【腐食は化学反応】の項で解説したように,電気化学(electrochemistry)で説明できる。すなわち,電流の作用を用いて人為的に金属の電位を制御し,腐食を制御することができる。この方法を電気防食法(electrolytic protection)という。
また,【腐食概論】・【腐食の開始と継続】の項で,金属の腐食し易さは,与えられた環境条件で決まる腐食電位から推定可能であること,腐食の速さは腐食反応のなかで律速となる反応段階で決まることを解説した。
要約すると,金属の腐食の程度は与えられた環境条件で異なるため,金属の標準酸化還元電位だけでは腐食の開始や速さを推定できない。従って,金属の腐食を理解するためには,金属が曝される環境における挙動の理解が必要になる。
腐食電位(corrosion potential)
腐食している金属の照合電極に対する電位。自然状態における腐食電位を自然電位(natural electric potential, spontaneous potential)ともいう。それを大きさの順に並べた物を腐食電位列という。【JIS Z0103「防せい防食用語」】
電極電位(electrode potential)
JIS K 0213 「分析化学用語(電気化学部門)」では
a ) 電極が溶液相などのイオン伝導体相と接しているとき,後者の内部電位に対する前者の内部電位。注記:この値を直接実測することは不可能である。
b ) 注目している電極系を,ある参照電極と組み合わせてガルバニ電池を構成させたとき,注目する電極に取り付けた金属端子の内部電位から,参照電極に取り付けた同種の金属端子の内部電位を差し引いた値。
すなわち,電極電位の絶対値を測定することは不可能で,知ることができるのは,基準とした電極との電位差である。
標準酸化還元電位(standard redox potential ,standard oxidation-reduction potential)
反応に関与する全ての化学種の活量が 1で,平衡状態にある時の熱力学的に求まる理論値である。
ギブズエネルギー変化⊿rG0 に対応する電位 E0 と定義される。
⊿rG0 = - zFE0
ここで,z :酸化還元反応で授受される電子数,F :ファラデー定数( 96,485 C mol-1 )
一般的には,標準電極電位(standard electrode potential),標準電位(standard potential),標準還元電位(standard reduction potential)とも呼ばれる。
標準電位列(electromotive force series)とは,金属の標準電極電位を,その大きさの順位並べ,金属のイオン化傾向及び一部の非金属元素の電気化学的酸化反応傾向の大きさの順を示した列。電気化学列ともいう。【JIS Z0103「防せい防食用語」】
ページのトップへ
電気防食の原理
環境条件として pHを選択し,金属の電極電位と pHの関係を求めることで,pHの腐食に与える影響を理解できるようになる。この関係は,1938年にマルセル・プールベが発表し,電位-pH図(EH - pH diagram),プールベダイアグラム(Pourbaix diagram),プールベ図などと呼ばれる。
電位-pH図を用いて電気防食の原理を次に紹介する。
鉄の電位-pH図を下図に示す。中性( pH7)の淡水に鉄を浸漬すると,鉄は図中の腐食域中の●の電位 -0.44V(Vs.SHE)を示し,腐食し続ける。
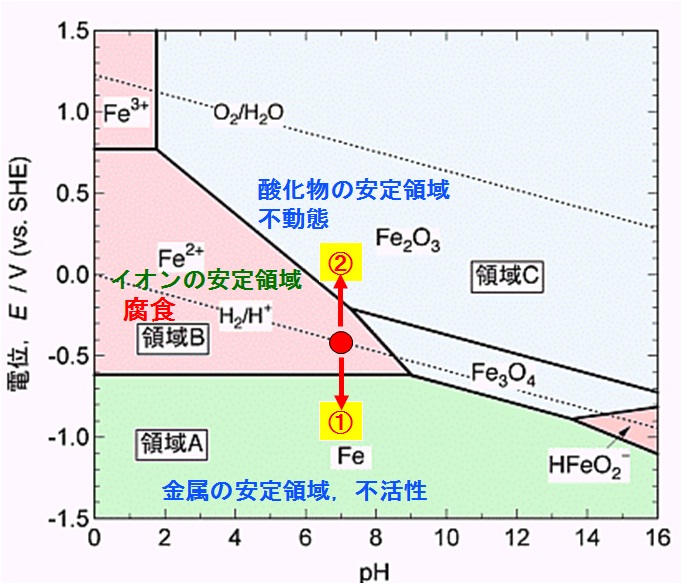
鉄の電位-pH図
出典:東北大学工学部 マテリアル開発系HPの図を編集
(http://www.material.tohoku.ac.jp/dept/lecture/lecture_03.html)
一方,逆に酸化物として安定な領域 ②に移動できれば,金属表面が安定した酸化物で覆われ腐食しない不動態(passive state)になる。また,鉄の電位-pH図から,溶液が pH2 以下の酸性では,電位を変えても酸化物として安定な領域に移動することができないことも分かる。
すなわち,鉄の置かれた環境において, ①又は ②の状態にすることで,鉄の腐食を抑制できることが示された。
①の方向に人為的に移動させる方法を陰極防食(カソード防食;cathodic protection)という。
②の方向に移動させる方法を陽極防食(アノード防食;anodic protection)という。
不動態(passive state)
これまでの文献等では,用語として不働態を用いていたが,現在は,JIS 用語を含め,不動態を用いる例が多い。
標準電位列で卑な金属であるにもかかわらず,電気化学的に貴な金属であるような挙動を示す状態。【JIS Z0103「防せい防食用語」】
本来,ひ(卑)である電極電位を示し,不安定であるべき金属があたかも貴である金属のように振る舞う状態。この状態では,電極電位も貴の値を示す場合が多い。【JIS H 0201「アルミニウム表面処理用語」】
一般的には,金属をとり囲む環境の影響で,電気化学列で卑な金属(腐食しやすい金属)が,表面を酸化物で覆われるなどして本来の活性を失い,貴な金属のように挙動する状態を不動態といい,この状態になることを不動態化(passivity)と理解されている。
不動態化は,酸化力のある酸にさらされた場合,陽極酸化処理によっても生じる。不動態となる酸化被膜(不動態被膜)の典型的な厚みは,数 nm である。
すべての金属が不動態となるわけではなく,不動態になりやすいのは,アルミニウム,クロム,チタンなどやその合金である。
ページのトップへ