腐食概論:腐食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(腐食の基礎)” ⇒
ここでは,腐食と化学反応に関連し, 【腐食反応と溶存酸素】, 【鉄腐食生成物について】, 【主な用語】 を紹介する。
腐食は化学反応
腐食反応と溶存酸素
鋼(steel)などの金属鉄を水溶液に没した場合に経験される鉄の“腐食”(corrosion)開始から“さび”(rust)の形成までの基本的な流れは次のように考えられる。
- 水溶液中の酸素(溶存酸素;dissolved oxygen )の量は,大気との平衡状態では,大気の気圧,水溶液の水温,及び溶存塩類濃度などによって一次的に決まる飽和溶存酸素量(oxygen saturation)になる。例えば,大気圧 1気圧,水温 23℃の蒸留水における飽和溶存酸素量は,8.39mg/ℓ である。
- 金属鉄を水溶液に浸漬した直後に,水溶液中の酸素分子が鉄表面に吸着(衝突)する。
- 【金属表面の特徴】で紹介したように,鉄表面の不均一さに基づいて,鉄表面のある部分にアノード(anode)が形成される。アノード部では鉄原子が電子を放出(酸化)しプラス 2価の鉄イオン(Fe2+)となり,金属表面から離脱する。
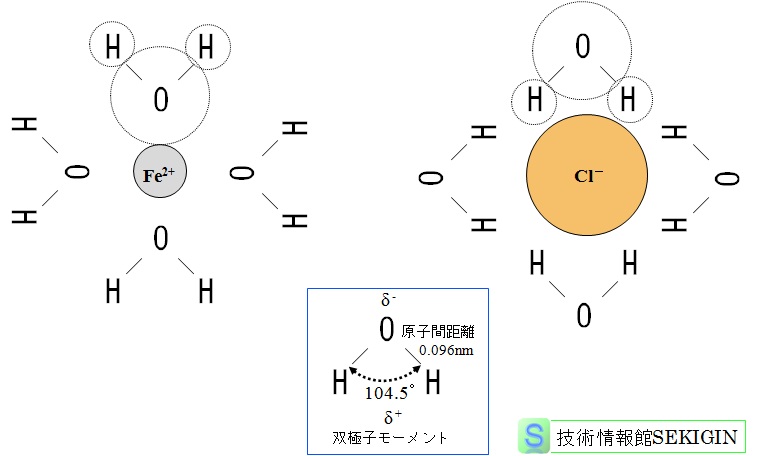
Fe2+のイオンサイズは,次の【参考】で紹介するように,陽イオンは最外殻電子がなくなることで,ゼロ価の鉄原子よりサイズが著しく小さくなる。
しかし,水溶液中では,上図に示すように,鉄イオンの周りに複数の水が静電気力(水の双極子モーメント(dipole moment))で配位し,大きなサイズのアクアイオン(古くはアコイオンといわれていた)として挙動する。文献等には,鉄のアクアイオンとして,[Fe(H2O)6]2+ の記述が見られる。 - アノードと対になるカソード(cathode)部では,表面に吸着した酸素が電子を受け取り,マイナス 2価の酸素イオン(O2-)になると同時に,周りの水から水素イオン(H+)を奪い,水酸化物イオン(OH-)になる。
- 腐食初期段階では,アノード表面近傍は,プラスイオンの多い水溶液となり,カソード表面近傍はマイナスイオンが多く,酸素の欠乏した水溶液となる。すなわち,表面からの距離に応じた濃度勾配が生じる。
- 熱力学第二法則(the second law of thermodynamics)に従うと,濃度勾配を解消するために物質の移動(拡散; diffusion)が始まる。
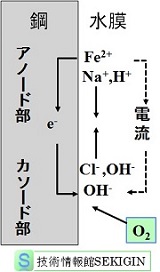
すなわち,アノード近傍では,金属のアクアイオンが沖合に向って移動し,カソード近傍では,水酸化物イオンが沖合に向って移動するとともに,酸素が沖合からカソードに向って移動する。 - 全体としては,金属の腐食反応により,金属内部を通って電子がアノードからカソードに向って移動し,水溶液内では,金属のアクアイオン(正の電荷)がアノードから沖合(カソード)に,水酸化物イオン(負の電荷)がカソードから沖合(アノード)向って移動する。
すなわち,右図に示すように,アノード→金属体内→カソード→水溶液→アノードを結ぶ電気閉回路が形成される。
(注:実用上問題となる腐食現象では,腐食反応で生成した酸化体,還元体の電位差に基づく直接的な電気泳動より,共存する塩等の支持電解質の移動が電気閉回路に寄与する。) - これにより,腐食継続の基盤が作られた。腐食が継続されるためには,電子を受け取る酸素がカソード部に供給され続けられる必要がある。この供給は,沖合との濃度差による酸素の拡散による。
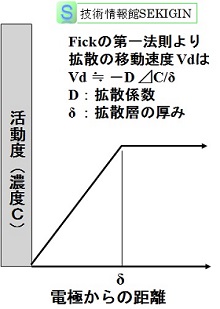
- 【酸素拡散律速とは】(diffusion-controlled process of oxygen)で紹介したように,酸素の還元速度が速く,カソードに到着した酸素は直ちに還元されるため,酸素濃度勾配の図に示すように,鉄表面の酸素濃度はほとんどゼロの状態になる。すなわち,腐食継続の速度は,沖合からの酸素の供給速度に依存する。
- アノードで生成した 2価鉄のアクアイオンは,沖合に拡散・移動する間に,以下の「鉄腐食生成物について」に例示する加水分解,水酸化物イオンとの酸塩基反応,及び又は溶存酸素による 3価鉄への酸化などを受け,難溶性の酸化鉄,オキシ水酸化鉄などの腐食生成物を生成する。これにより,水溶液中から鉄イオンが取り除かれる。なお,金属表面に沈着した腐食生成物は“さび(rust)”と称される。
水の構造とアクアイオン(模式図)
物質移動(模式図)
酸素濃度勾配(模式図)
静止水の拡散層の厚み 概ね 500μm
ページのトップへ
鉄腐食生成物について
鉄イオンから腐食生成物に至る代表的な化学式の例を次に示す。なお,簡単のため水和を(aq)で表わした。
加水分解 :Fe2+ (aq) → Fe(OH)2・nH2O + 2H+
酸塩基反応 :Fe2+(aq) + 2OH- → Fe(OH)2・nH2O
酸化反応 :4Fe(OH)2 + O2 → 4FeOOH + 2H2O
FeOOH は,オキシ水酸化鉄(iron(III) oxide-hydroxide , ferric oxyhydroxide),又は含水酸化鉄と呼ばれ,大気環境で腐食した鉄の主要な成分(最終生成物)として知られる。
なお,腐食生成物の解説の中には,大気環境で観察される赤色の腐食生成物を赤さびと称し,その化合物を酸化鉄(Ⅲ)Fe2O3(ヘマタイト,hematite)と記しているものもあるが,この化合物は,常温の腐食環境では生成せず,高温や高い圧力の影響を受けた場合に生成する化合物である。
常温の大気環境などで広く観察される腐食生成物は,オキシ水酸化鉄 FeOOH であるが,オキシ水酸化鉄には結晶構造の違うもの(多形:polymorph),及びX線回折的非晶質なものが知られている。
結晶性化合物の中ではγ-FeOOH(レピドクロサイト,lepidocrocite)が多く観察され,徐々に安定なα-FeOOH(ゲーサイト,goethite)に結晶変態すると考えられている。
腐食生成物の中にβ-FeOOH(アカガネイト,akaganéite)が検出された場合には,腐食環境中に多くのハロゲンイオン(塩化物イオンなど)が存在し,この影響を強く受けて腐食したことが推定できる。
また,空気酸化の程度により,複雑な中間生成物(ミドリ錆など)を経由して最終生成物に至るが,遅い酸化過程を経た場合には,鉄(Ⅱ)と鉄(Ⅲ)の化合物である四三酸化鉄 Fe3O4(マグネタイト,magnetite)の生成量が増加する。また,マグネタイトは,さび層が厚くなり,鉄素地への酸素拡散量が低下すると,γ-,及びX線回折的非晶質含水酸化鉄の還元反応で生成することも知られている。
ページトップへ
主な用語の概説
電極(electrode)
電気化学では,広義には金属などの電子伝導体の相と電解質溶液などのイオン伝導体の相とを含む少なくとも二つの相が直列に接触している系(電極系ともいう)。狭義にはイオン伝導体に接触している電子伝導体の相。【JIS K 0213「分析化学用語(電気化学部門)」】
電極を示す名称には,カソード・アノード,正極(+極)・負極(-極),陰極・陽極などの名称が使われている。特に,陰極・陽極の用語は,技術分野で示す意味が異なり,混乱した使用例が見られるので,注意が必要である。
なお,カソード(cathode)は還元反応を生じる電極,アノード(anode)は酸化反応を生じる電極をいう。
溶存酸素(dissolved oxygen)
DOと略称され,水中に溶解している酸素の量を意味し,一般的には水の汚染の程度を示す指標として用いられる。海洋や河川では,4~5mg/L を下回ると水中生物の生命が脅かされるといわれている。
酸素の溶解量は水温,溶解塩類の濃度,気圧などにより影響を受ける。ちなみに,1気圧の蒸留水の飽和溶存酸素量は,20℃で 8.84mg/L ,25℃で 811mg/L ,30℃で 7.53mg/L である。
拡散(diffusion)
物質,熱(エネルギー),運動量(エネルギー)などが自発的に散らばり広がる物理現象をいう。
物質の拡散は,原子や分子の熱運動に基づく運動で,気体や液体でのブラウン運動や浸透現象として一般的に認識されている。固体中の原子も熱によってランダムに跳躍した結果として正味の原子移動が起きる。
熱(エネルギー)の拡散は,温度勾配のある物質中を熱が移動する熱伝導として知られる。
運動量の拡散は,固体表面を流れる流体の層流の問題で,運動量が固体表面近くの境界層を通して拡散する現象である。
加水分解(hydrolysis)
水分子と反応し,反応物が分解した生成物が得られる反応である。このとき水分子( H2O )は,H+ と OH- に分割されて生成物中に取り込まれる。
アクアイオン(aqua ion)
以前はアコイオン(aquo ion)といわれていた。水分子 H2O が金属イオンに一定の比で配位している状態のイオンをいう。この状態の配位子(水分子)をアクアといい, M n+(aq) などで表記する。
多くの金属イオンは,水分子が配位しやすいため,金属塩が水に溶解している場合の多くはアクア化し,安定な錯イオン(イオンとして挙動する錯体)になると考えられている。
例えば,[Ni(H2O)6]2+ ,[Zn(H2O)4]2+ ,[Al(H2O)6]3+ ,[Co(H2O)6]2+ ,[Fe(H2O)6]3+ ,[Fe(OH)(H2O)5]2+ などが知られている。
水酸化鉄(Ⅱ)(iron(II) hydroxide)
水酸化第一鉄ともいい,Fe(OH)2 。無色ないし淡緑色粉末結晶。空気中で容易に酸化され水酸化鉄(Ⅲ)になる。
水酸化鉄(Ⅲ)(iron(III) oxide hydroxide)
水酸化第二鉄ともいい,赤褐色の粉末。一般には Fe(OH)3 と表記されるが,水酸化鉄(Ⅱ)とは異なり,実際には鉄と水酸化物イオンとを 1:3 で含む化合物が無く,一般組成式は,脱水されたオキシ水酸化鉄(酸水酸化鉄) FeO(OH)・H2O ,又はさらに脱水の進んだ水を含む酸化鉄(含水酸化鉄) 2Fe2O3・3H2O として表される。
ちなみに,水酸化鉄(Ⅲ)の溶解度積 Ksp は,
FeO(OH) + H2O ⇆ Fe3+(aq) + 3OH‐(aq) ,Ksp = 1×10‐38
で与えられる。
オキシ水酸化鉄(iron(III) oxide-hydroxide , ferric oxyhydroxide)
水酸化鉄(Ⅲ)の表記,一般組成式 FeO(OH)・H2O ,すなわち, Fe(OH)3 の脱水形の化合物として,オキシ水酸化鉄(酸水酸化鉄)という。なお,一般的には FeOOH と表記する例が多い。
オキシ水酸化鉄は,鉄の酸化数,結晶構造の異なる複数種存在する。例えば,同質異像の関係(多形)にある鉄(Ⅲ)化合物には,ケーサイト(針鉄鉱,goethite)と呼ばれるα-FeOOH ,アカガネイト(赤金鉱,akaganéite)と呼ばれるβ-FeOOH ,レピドクロサイト(鱗鉄鉱,lepidocrocite)と呼ばれるγ-FeOOH ,フェロオキシハイト(feroxyhyte)と呼ばれるδ-FeOOH がある。
組成が異なるものには,フェリハイドライト(ferrihydrite)と呼ばれるFe2O3·0.5H2O ,シュバートマンナイト(schwertmannite)と呼ばれる少量の硫酸イオンを含むFe8O8(OH)6(SO4)·nH2O がある。
酸化数の異なる鉄(Ⅱ,Ⅲ)の化合物にはさび発生の中間生成物として知られるみどり錆(green rust)がある。みどり錆の組成式の例として Fe(III)Fe(II)3(OH)8Cl が知られる。
含水酸化鉄
水酸化鉄(Ⅲ)の表記,一般組成式 2Fe2O3・3H2O ,水を含む酸化鉄(含水酸化鉄)。現在はオキシ水酸化鉄と称するのが一般的である。
多形(polymorph)
同一の化学組成をもつが,互いに結晶構造が異なる状態を同質異像(どうしついぞう,polymorphism)という。異なる結晶構造,すなわち相が 2 種類の場合を同質二像,3 種類の場合を同質三像という。
各相の関係を多形という。なお,単一元素の固体(単体)の場合は互いに同素体(allotropy)ともいう。多形の表示にギリシャ文字を用い,α相,β相,・・・で表す例が多い。
ゲーサイト(goethite)
オキシ水酸化鉄(FeOOH)の一種,鉄の酸化鉱物である針鉄鉱(しんてっこう)の鉱物名で,化学式α-FeOOH で表される。
アカガネイト(akaganeite)
岩手県奥州市江刺区の赤金鉱山において,南部松夫(東北大学教授)らが発見した新鉱物で,発見場所に因み赤金鉱(akaganeite)と命名された。当初は,オキシ水酸化鉄(FeOOH)のβ変態(β-FeOOH)とされていたが,塩素(Cl)が必須の化学組成であることが分かり,現在の化学組成式は(Fe3+,Ni2+)8(OH,O)16Cl1.25 · nH2O で与えられている。
なお,腐食・防食分野では,腐食生成物として検出されるオキシ水酸化鉄の中で,塩化物イオン(Cl-1)などのハロゲンイオンの影響で生成したオキシ水酸化鉄(β-FeOOH)をアカガネイト(akaganéite)と称している。
レピドクロサイト(lepidocrocite)
オキシ水酸化鉄(FeOOH)の一種,燐鉄鉱(りんてっこう)の鉱物名で,化学式γ-FeOOH で表される。
マグネタイト(magnetite)
鉄(Ⅱ),鉄(Ⅲ)の酸化鉱物の磁鉄鉱(じてっこう)の鉱物名で,化学式 Fe3O4 で表される。
ページのトップへ