第一部:化学と物質構造・金属結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,周期表と金属元素に関して【周期表での元素分類】, 【周期表と金属元素の電子状態】 に項目を分けて紹介する。
周期表での元素分類
金属元素の理解のため,【元素の分類】の概要を次に示す。
化学的性質による分類
周期表は,原子の電子配置の違いを原因とする化学的性質の違いを基準に元素を分類したものである。
元素は,周期表中の化学的性質の変化の違いから,遷移元素と典型元素に分けられる。
遷移元素 ( transition element )
原子の電子配置に基づく元素分類の一種(電子軌道 d 軌道あるいは f 軌道が閉殻でない元素)で,周期表の 3族から 11族(12族を含める学者もいる)までの全ての元素をいう。各族の縦の類似性はあまり著しくなく,横の類似性が目立つ元素類である。
典型元素 ( typical element )
遷移元素以外の元素(周期表の第 1 族,第 2 族と第 12 族から第 18 族)の総称で,各族で縦の類似性が大きい。これが,典型の語源で,周期表の特徴をよくあらわしている。
金属性による分類
単体の特性(金属性)の違いで,高等学校教育など一般的には,金属元素と非金属元素の 2種に分類している例が多い。分野によっては,工学上の便利さから,金属元素,半金属元素,及び非金属元素に分類されことがある。
金属元素( metal )
単体が金属としての性質を持つ元素の総称とされている。
非金属元素( nonmetal )
金属元素以外の全ての元素の総称とされている。
半金属元素( metalloid :メタロイド)
周期表上で金属と非金属との境界付近の元素で,金属と非金属の両方の性質を持つものとされ,ホウ素 ( B )・ケイ素 ( Si )・ゲルマニウム ( Ge )・ヒ素 ( As )・アンチモン ( Sb ) ・テルル ( Te ) ・ポロニウム ( Po ) ・アスタチン ( At )をいう場合が多い。
例えば,ダイヤモンド構造のケイ素は金属の性質を示さないが,βすず構造のケイ素は,金属の性質を示す。
半金属元素の定義が曖昧なため,日本の高等学校教育では,ゲルマニウム ( Ge )・アンチモン ( Sb ) ・ポロニウム ( Po )を金属元素,ホウ素 ( B )・ケイ素 ( Si )・ヒ素 ( As )・テルル ( Te ) ・アスタチン ( At )を非金属元素に分類した周期表を用いている。
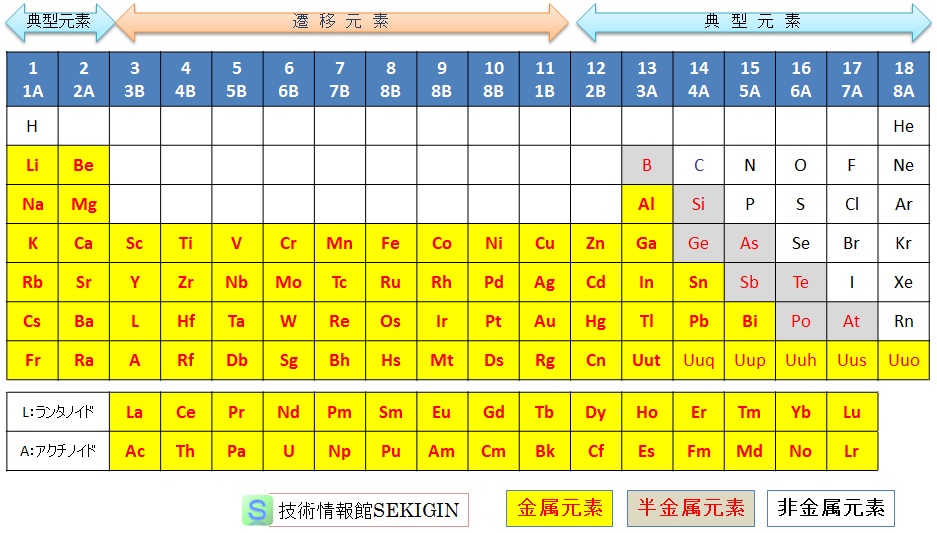
周期表
【参考】
周期表( periodic table )
広く利用されている周期表は,ロシアの化学者メンデレーエフによって提唱された。当時発見されていた元素を単体や化合物の性質で分類し,原子量順に整理することで,未発見の元素性質の予言を目的とした。
周期表には,長周期型周期表と短周期型周期表の 2種類がある。長周期型は,1族~ 18族で分類するのに対し,短周期型は,1族~ 8族に分類し,各族はさらに A, Bに分けられる。また,長周期型の 8 ~10族は,短周期型では 8B族(鉄族などとも称される)にまとめられている。
長周期型は,国際純正・応用化学連合 ( IUPAC ) の推奨で,日本高校教育で採用している。米国では,今でも短周期型が一般的である。
ページのトップへ
周期表と金属元素の電子状態
周期表の第 1 族は,s 軌道に不対電子を 1 個持つ,第 3 族から第 11 族の遷移元素は d 軌道に不対電子を持つ。
これらの元素(水素を除く)で等核の巨大分子を形成した場合に,【エネルギーバンド】の模式図に示したように,エネルギーギャップのほとんどない価電子帯と伝導帯を有し,価電子帯の電子が容易に空の伝導帯に昇位し自由電子( free electron )になれる。
なお,水素も超高圧下では凝集し,金属の特性を示すといわれている。
第 2 族と第 12 族は,s 軌道が電子対で満たされており,このままでは共有結合も金属結合も生じない。しかし,s 軌道の電子が p 軌道に昇位することができると,sp 混成軌道を形成し,2 個の不対電子を持つことができる。
sp 混成軌道は二方向性の結合となるので,結晶は六方最密充填構造をとり易い。実際に,ベリリウム( Be ),マグネシウム( Mg ),亜鉛( Zn )の金属結晶は六方最密充填構造である。
また,第 2 族 4 周期( Ca )より原子番号の大きい元素(アルカリ土類金属)では,空の d 軌道を加えた混成軌道を形成できる。
第 13 族から第 17 族の典型元素は, p 軌道に不対電子を持つが,原子番号の小さい元素の等核原子分子では共有電子対による共有結合性が高く金属結合性は低い。原子番号が大きくなると,結合に関わる電子の数が増え,同じ族でありながら非金属性,半金属性,金属性と変化する。
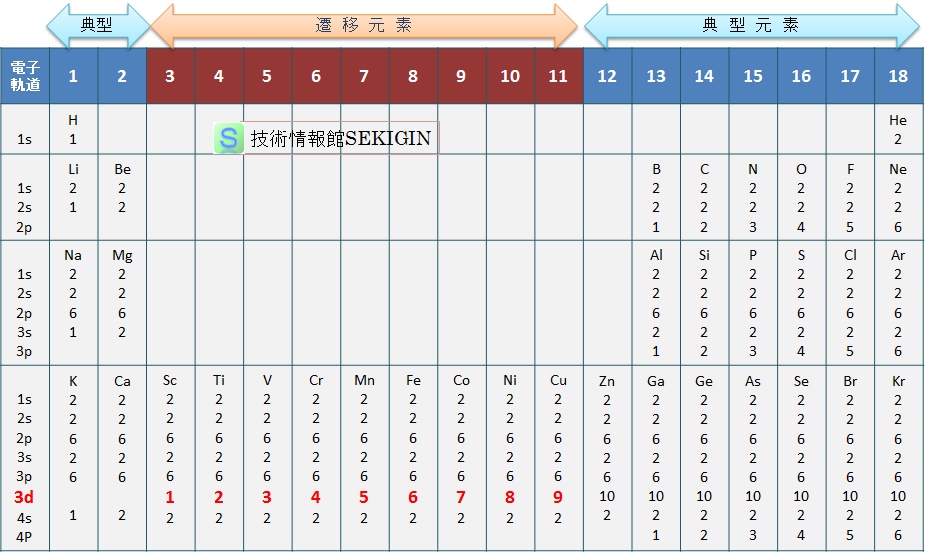
原子の電子配置
【参考】
自由電子( free electron )
自由電子とは,束縛を受けていない電子をいう。即ち,特定の原子核の近傍に留まらず結晶全体に非局在化している電子である。
自由電子の存在が,電気や熱の高い伝導性の要因の一つとなっている。このため,自由電子は伝導電子とも呼ばれる。
ページの先頭へ