第一部:化学と物質構造・その他の結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
水素結合の影響
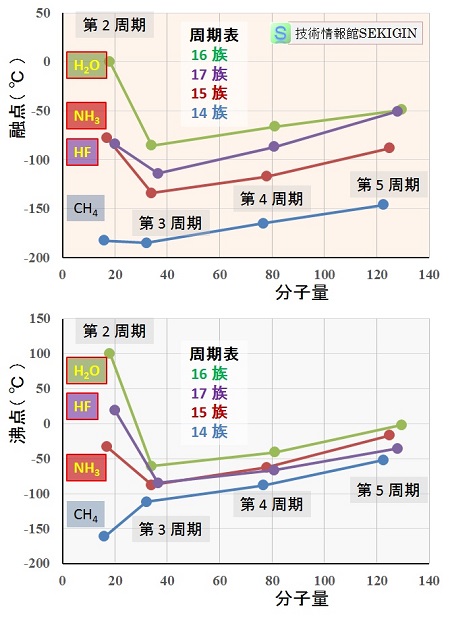
水素化物(周期表 14~17族)の分子量と融点・沸点
この現象は,液体や固体などの分子同士の距離が近い状態で,分子内の電荷の偏り(双極子)を原因とした静電的力の影響を強く受けていると考こと。加えて正電荷の影響が水素を介していることに原因があると考えられている。
水素を介して分子間に静電的引力(クーロン力)が働くために,分子間にファンデルワールス力( Van der Waals force )のみが作用する場合の分子の配列(凝集)とは異なる規則性が生じていると考えられている。
この分子間に水素を介して働く力を水素結合( hydrogen bond )といい,ファンデルワールス力より分子間に作用する力は大きい。なお,電子の移動を伴うイオン結合や共有結合に比較してはるかに弱い力で,分子間相互作用の範疇に入る。
右図には,周期表第 14 族から第 17 族までの元素の水素化物の分子量に対する融点(℃),及び沸点(℃)の関係を示した。
分子の集合した液体や固体の状態は,分子間の相互作用の大きさを反映する。すなわち,分子間のファンデルワールス力の強さと分子の詰まり方に依存すると考えられる。
図に示すように,周期表第 3 周期から第 5 周期までは,同族元素の水素化物(類似の分子構造)は,分子量(電子,原子核の数)の増加とともに,融点,沸点とも増加している。
すなわち,分子構造が類似の場合は,電子の数,原子核の数が多いほど電子雲が歪み強くなるファンデルワールス力と融点及び沸点の増加に正の相関が認められる。
一方,第 2周期の元素の水素化物は,第 14族の炭素を除き,分子量が小さいにもかかわらず,同族元素の第 3周期より融点,沸点とも異常に高くなっている。このことは,これらの分子にファンデルワールス力以外の強い分子間力(水素結合)が働いていることを示す。
【参考】
電気陰性度( electronegativity )
化学結合にあずかる電子(共有電子対)を引き寄せる力の強弱を表す尺度である。
一般的には,電気陰性度の小さい元素は,陽性が強く(陽イオンになり易い),大きい元素は,陰性が強い(陰イオンになり易い)と考えてよい。
電気陰性度の尺度を決める方法が種々提案されている。 この中で,広く用いられているのは,二原子分子の解離エネルギー,共有結合エネルギー,イオン結合エネルギーなどから求めたポーリング提案の値である。
分子間力( intermolecular force )
分子間力とは,電気的に中性の分子間に作用する力で,気体から液体や固体への相転移( phase transition :変態ともいう)で重要な役割を果たす。
一般的な液体で影響する主要な力は,“ファンデルワールス力”で,液体の特性や固体の結晶化などでは“双極子に基づく力”の影響を受けると考えられる。“水素結合”については,原子間の電気陰性度に大きな差があり,大きい双極子モーメントが発生する構造を持つ特定の分子(水やアンモニアなど)で問題となる。
ファンデルワールス力( Van der Waals force )
互いに近づいた原子,分子,及びイオン間に働き,その力は粒子間の距離の 6 乗( 7 乗とする文献も)に反比例する。従って,力の作用する距離は限られた範囲となる。
クーロン力( Coulomb force )
クーロン力は,静電力,静電気力,静電引力などともいわれる荷電粒子間に働く力。
クーロンの法則( Coulomb’s Low )
フランスの物理学者クーロンが提案した電磁気学の基本法則で,電荷のクーロンの法則と磁荷のクーロンの法則がある。
電荷のクーロンの法則とは,荷電粒子間に働き,反発又は引き合う力(クーロン力)が,それぞれの電荷の積に比例し,距離の2 乗に反比例(逆 2 乗の法則)する。
磁荷のクーロンの法則とは,磁気を帯びた粒子間に働く力に関しても,電荷のクーロンの法則と同様に,距離の逆2 乗の関係がある。
ページの先頭へ