第一部:化学と物質構造・共有結合
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
電子雲の重なり
分子の結合に関わる電子の状態は,周期表第一周期の水素原子では最外殻電子 2個のヘリウム( He ),周期表第二周期や第三周期の原子では最外殻電子 8個の,ネオン( Ne ),アルゴン( Ar )などの希ガス状態になろうとする。
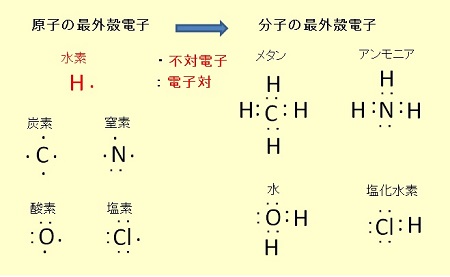
例えば,下図に示すように,最外殻電子 1個の水素原子と,最外殻電子が 4個の炭素原子,5個の窒素原子,6 個の酸素原子などの周期表第二周期の元素との反応では,水素は最外殻電子 2個のヘリウム( He ),結合相手の元素は最外殻電子 8個のネオン( Ne )と同じ電子状態( electronic structure )の分子になることで安定する。また,周期表第三周期の最外殻電子 7個の塩素原子との反応では,最外殻電子 8個のアルゴン( Ar )と同じ状態の分子になることで安定する。
これらの元素の電子配置は,
炭素(原子番号 6 ) : 1s2 2s2 2p2
窒素(原子番号 7 ) : 1s2 2s2 2p3
酸素(原子番号 8 ) : 1s2 2s2 2p4
塩素(原子番号 17 ): 1s2 2s2 2p6 3s2 3p5
である。いずれも最外殻の p 軌道は電子で満たされていないのが分かる。
なお,多くの化合物において,共有結合に関わる最外殻電子は 8個となるが,例外として,三塩化ホウ素( BCl3 )で 6個,五塩化リン( PCl5 )で 10個が知られている。
不対電子の共有と分子の形
【原子の構造】で解説したように,p軌道は,方位量子数 l = 1 ,磁気量子数 m = -1 , 0 , 1 の 3 つの軌道をもつ。 p軌道に電子が入るとき,電子 3個までは,磁気量子数 m の異なるそれぞれの軌道に順番に入る。
不対電子の共有(共有結合)例
窒素( N )は,3 つの P 軌道に 3個の不対電子,酸素( O )は 1 組の電子対(電子 2 個)と 2個の不対電子,塩素( Cl )については 2 組の電子対(電子 4 個)と 1 個の不対電子を持つ。
窒素,酸素,塩素では,これらの不対電子と水素とが共有結合し,三角錐の頂点に原子が配置した分子構造( NH3 が三角錐,H2O は折れ線,HCl で直線)を形成する。
一方,炭素( C )は,3つの p軌道に 2個の不対電子しかないが,メタン( CH4 )で知られるように,4個の水素と共有結合できる。
これは,炭素の s軌道と 3つの p軌道の混合が起こり 4個の不対電子を持つ混成軌道( hybrid orbital )が生成したためである。なお,混成軌道については,次項で紹介する。
【参考】
分子軌道( molecular orbital )
単原子分子(希ガス)を除き,複数の原子で分子を構成した場合には,結合に関与した電子は,原子間距離に応じて,一つ以上の原子核と相互作用をもつ分子軌道で記述される。
電子軌道( electron orbital )
当初の原子モデル(惑星モデル)では,電子の運動を“orbital”と考え,軌道と訳されているため,電車の軌道,衛星軌道などのように,一定の法則に従って運動するときの筋道と錯覚されるが,最新の原子モデルでは,electron(電子の)orbital(軌道のようなもの)は,電子の状態を波動関数(wave function)で表したもので,雲のように広がった連続的分布をしていると考えられている。この電子の分布は,電子雲(electron cloud)ともいわれる。
電子軌道は,主量子数( main quantum number ) n ,方位量子数( azimuthal quantum number ) l (エル) ,磁気量子数( magnetic quantum number ) m で指定される。
主量子数 n は,軌道の大きさとエネルギーを決定し,1, 2 , 3 , …の整数値をとる。これは,電子殻( K 殻, L 殻, M 殻, … )に対応する。
方位量子数 l は,軌道の形を決定し,0 , 1, 2 , … n-1の整数値をとる。これは,s 軌道,p 軌道,d 軌道,f 軌道,h 軌道に対応する。すなわち,K 殻 ( 主量子数 1 ) では l = 1 - 1 = 0となり,s 軌道しかとりえないが, N 殻 ( 主量子数 4 ) では l = 4 - 1 = 3 となり,s 軌道,p 軌道,d 軌道をとることができる。
磁気量子数 m は,各軌道を決定し,0 , ± 1, ± 2 , … ± l の整数値をとる。従って,s 軌道は, l = 0, m = 0 で 1 つの軌道を,p 軌道は l = 1 , m = -1 , 0 , 1 で 3 つの軌道を,d 軌道は l = 2 , m = -2 , -1 , 0 , 1 , 2 となり 5つの軌道を持つことができる。
パウリの排他原理( Pauli principle )
パウリにより提唱された原理で,排他律あるいは禁制原理などとも呼ばれる。「 2つ以上のフェルミ粒子は,同一の量子状態を占めることはできない。」と表現され,一つの原子内では,2 個以上の電子が同時にエネルギー・スピンなどの同じ状態をとることはないことを示す原理である。
ページの先頭へ