腐食概論:腐食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(腐食の基礎)” ⇒
ここでは,腐食と化学反応に関連し, 【腐食反応と電荷保存則】, 【主な用語】 を紹介する。
腐食は化学反応
腐食反応と電荷保存則
腐食現象を化学反応で表記する場合には,当然のこととして従うべき法則があるので,省略せず,矛盾しないように記述しなければならない。
化学式の表記では,基本法則として,反応前後の質量が維持される質量保存の法則(law of conservation of mass),反応前後の元素の質量比が常に変わらない定比例の法則(law of definite proportions)や倍数比例の法則(law of multiple proportions)に従わなければならない。
金属の腐食現象は,金属表面での酸化還元反応(oxidation-reduction reaction)の結果として表れる。金属表面の特徴で紹介したように,酸化反応と還元反応が異なる位置で起きる。このため,化学反応を酸化反応と還元反応の半反応式(half reaction)で表すことが多い。
この際には,酸化還元の全反応として,反応前後で電荷の総量が変わらないという電荷保存則(law of conservation of charge)を忘れないように注意しなければならい。
物質移動(模式図)
中性塩水中での鋼腐食の酸化還元反応は,質量保存の法則,定比例の法則,電荷保存則に従い,
2Fe + O2 + 2H2O → 2Fe2+ + 4OH‐
と記述される。
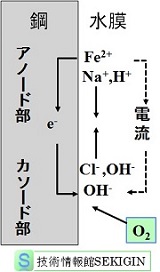
実際の鋼表面では,酸化反応と還元反応が異なる場所で生じる電極反応(electrode reaction )と考えられる。従って,酸化反応の起きるアノード(アノード反応)と還元反応の起きるカソード(カソード反応)に分け,全体としての電荷保存則に注意して,半反応で表記すると,
アノード反応: 2Fe → 2Fe2+ + 4e‐
カソード反応: 4e‐ + O2 + 2H2O → 4OH‐
となる。
半反応式から分かるように,全反応が進むためには,酸化反応(アノード反応)で生成した電子は,鋼の内部を通って還元反応の場所に移動しなければならない。また,電子の移動量に見合う電荷が,鋼に付着する水膜中を移動しなければならないことが分かる。
一般的に,腐食が発生する条件の水膜中には,水膜の電気抵抗率に見合う電解質(支持電解質ともいう)が含まれている。このため,溶液中の電荷の移動では,反応生成物である鉄イオン(Fe2+)や水酸化物イオン(OH‐)の移動が必須ではなく,電解質中のプラスイオン(例えば塩水のNa+など)が酸化反応の場所から還元反応の場所に向い,マイナスイオン(例えば塩水のCl-など)が逆方向に向って移動することで,電荷の移動が起きるので,反応生成物移動のみで考慮される反応速度より速い速度で腐食反応が進む。
ページトップへ
主な用語の概説
電極反応(electrode reaction)
電極と電解質溶液,溶融塩などのイオン伝導体との間で起こる少なくとも一つの電荷移動過程,及びそれに伴って電極近傍で起こる物質移動,化学反応などの全ての過程。狭義には,電荷移動過程だけをいう。【JIS K 0213 「分析化学用語(電気化学部門)」】
電極反応には,電極と電解質で構成される系,電極と電解質溶液で構成される 2 つの系があり。問題(研究対象)とするのは,電解質,又は電解質溶液全体で均一に進む現象ではなく,電極との界面で生じる酸化還元反応,すなわち不均一系の反応である。
電荷保存則(law of conservation of charge)
電気量保存の法則,電気中性条件ともいい,確認できる全ての反応(化学反応,原子核反応,粒子の崩壊・対生成・対消滅など)で電荷が保存されない事例が発見されていないという経験的事実から導き出された“電荷の総量は永遠に変わらない。⇒ 閉じた系の正・負の電荷の代数和は常に一定”という法則である。
ページのトップへ