腐食概論:腐食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(腐食の基礎)” ⇒
ここでは,腐食の速さに関連し, 【環境因子と腐食速さ】, 【主な用語】 を紹介する。
腐食の開始と継続
環境因子と腐食速さ
金属表面に到達する酸素の量や腐食反応で生成したイオンの移動に影響する要因は,金属の腐食量に影響する。この例として,鋼表面に付着した水膜厚みと腐食速さの関係で解説する。
下図は,水膜厚みと腐食速さの関係を説明する一般的な模式図である。
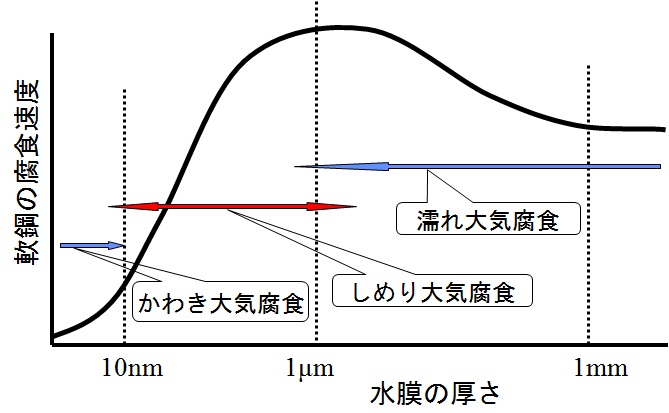
大気中水膜厚みと軟鋼の腐食速さ
参考:H. Uhlig, D. Triadis, M. Stern, J. Electrochem. Soc., 102, 59(1955)
水分子吸着層が 100分子程度までの水膜厚みによる腐食をかわき大気腐食と呼ばれる。この領域では,水膜の大多数が金属表面に吸着(adsorption)した水分子である。
すなわち液状の水とは異なり移動困難な水分子で構成される。水膜が非常に薄く移動し難いので,カソード反応(還元反応)に必要な十分な量の酸素が容易に供給されるが,腐食反応で生成したイオンの移動が著しく制約される。このことは,電気抵抗が著しく大きい腐食電池に相当し,アノードとカソードの電位差が大きくとも電流に相当する腐食速度は非常に小さくなる。
しめり大気腐食
水膜が厚くなると,【清浄表面の濡れ】で説明するように,水分子の吸着層の上に自由に動ける水の層が増え,イオンの移動が容易になる。
水膜厚みの増加で,大気からの拡散による酸素の供給量は低下するが,イオンの移動し易さが増すことで,腐食速度が増加する。この領域をしめり大気腐食と称する。
濡れ大気腐食
さらに水膜が厚くなり,イオンの移動に対する制約が液体の水と変わりなくなると,腐食速度は,【酸素拡散律速とは】で解説したカソード部での酸素消費量に依存する。
水膜が1μm程度になると,目視で表面の濡れが確認できる状態となり,この状態から濡れ大気腐食などと呼ばれる。水膜厚みの増加(酸素拡散層の増加)と共に,大気からカソード部に供給される酸素量はフィックの法則に従い減少する。このため腐食速度も水膜厚みの増加と共に減少し始める。
水膜厚みが1mm程度以上では,酸素拡散層の厚み(静止した水で概ね 500μm)より厚いため,鋼表面で消費される酸素量,すなわち水膜の沖合から鋼表面に拡散してくる酸素量が水膜厚みの増加によらず,ほぼ一定となる。このため,水膜厚みが増えても,腐食速度が一定(酸素拡散律速)になる。
ページトップへ
主な用語の概説
吸着(adsorption)
気相と液相,液相と固相,気相と固相,互いに混じり合わない液相と液相など,2相が接しているとき,物質の濃度(密度)が界面近くと相内で異なる現象をいう。
界面近くの濃度が内部よりも大きいのを正吸着,逆を負吸着と呼ぶ。一般的に吸着という場合は,正吸着をいう。
吸着の原因が化学結合力による場合を化学吸着,ファン・デル・ワールス力による場合を物理吸着といい,吸着で発生する熱量を吸着熱という。
フィックの法則(Fick's laws of diffusion)
気体,液体のみならず固体(金属)にも適用できる物質の拡散に関する基本法則である。フィックの法則には第 1法則と第 2法則がある。
フィックの第 1法則 : “拡散束(流束;flax)は,濃度勾配に比例する”と表現される法則で,定常状態拡散(濃度が時間で変わらない)で適用される。
拡散係数を D ,位置 x での濃度 c とした時,拡散束 J は,
J = − D grad c あるいは J = − D ( dc /dx ) で与えられる。
フィックの第 2法則 : 実際の拡散で見られる濃度が時間に関して変わる非定常状態拡散に適用される。拡散係数 D が定数のとき,濃度 c の時間変化は,
∂c /∂t = − div J = D∇2 c あるいは∂c /∂t = D (∂2 c /∂x2 ) で与えられる。
酸素拡散律速(diffusion-controlled process of oxygen)
水の関与する金属腐食では,酸化反応が起きる場所と還元反応の場所が異なる。例えば,鉄の腐食では,鉄の酸化反応とそれに対応する酸素の還元反応が鉄表面の異なる場所で起きる。
この時,鉄の酸化反応と酸素の還元反応の結果で生じる鉄イオンの生成速度ν[Fe2+]は,反応速度論に従うと,反応物質の活量の積に比例する。すなわち,鉄表面の酸素濃度に比例する。また,鉄の酸化還元の反応速度は,静止する水中での酸素移動速度(拡散速度)より著しく大きいので,鋼表面に到達した酸素は,直ちに還元される。
結果として,鉄イオンの生成速度は,鋼表面に到達する酸素の量,すなわち酸素の拡散束(流束)に依存し,酸化還元反応の速度定数には依存しないことになる。この現象を,一般的には酸素拡散律速の腐食といっている。
腐食速度と腐食度(corrosion velocity Vs corrosion rate)
腐食速度(corrosion velocity)とは,金属腐食に関わる化学反応の反応速度(reaction velocity)をいう。反応速度とは,化学反応において,反応物(又は生成物)の量の時間変化率を表す物理量と定義される。
一般的に,金属の腐食過程では,腐食速度は時々刻々変化するので,暴露試験など比較的長い時間間隔で計測した腐食反応物や生成物の変化量を示す場合は,腐食速度(corrosion velocity)ではなく,腐食度(corrosion rate)や侵食度(penetration rate)を用いるのが良い。
ページのトップへ