腐食概論:腐食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(腐食の基礎)” ⇒
ここでは,腐食と化学反応に関連し, 【腐食の継続】, 【主な用語】 を紹介する。
腐食の開始と継続
腐食の継続について
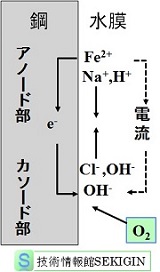
鋼表面に水が付着すると,鋼表面の格子欠陥などの構造欠陥がアノード(anode)となり,腐食の半反応である式 1) に示す鉄(Fe)の酸化反応(oxidation reaction)が起き,鉄イオン(Fe2+)と電子(e-)が生成する。この反応はアノード反応や陽極反応ともいわれる。
Fe → Fe2++2e- ・・・・・・ 1)
ここで生成した鉄イオンは,鋼表面から水中に拡散し,電子は鋼の内部を自由に移動する。
カソード(cathode)では,アノード反応で生成した電子と同数の電子が式 2)の酸素の還元反応(reduction reaction)で消費される。この反応はカソード反応や陰極反応ともいわれる。
4e-+O2+2H2O → 4OH- ・・・・・・ 2)
アノードとカソードは,鋼内部を通じで電気的に接続されている。鋼に付着した水の膜が電気的に接続されなければ,アノード反応で生成した鉄イオンやカソード反応で生成した水酸化物イオンの拡散は遅いので,あたかも直流回路におけるコンデンサーのように,両者間の電位差が解消され,反応がほとんど進まない。
アノードとカソードの間の水膜を電気的に接続するためには,金属内部の自由電子のような存在,すなわち反応には直接関与しない多くのイオンが必要である。このイオンを供給するため,金属に接触した水には,比較的多くの電解質(electrolyte)を含む必要がある。この電解質を支持電解質(supporting electrolyte)という。
物質移動(模式図)
この腐食回路で生成するイオン量は,ファラデーの電気分解の法則に従う。
Q=zFN ・・・・・・ 3)
ここに,Q:通過電気量(C),z:反応に含まれる電子数,F:ファラデー定数,N:化学変化量(mol)
鉄(原子量 M = 55.845 )の場合は,m(g)の反応に必要な式 1) の電気量は Q = 2・(9.6485×104)・m/55.845 となる。
通過電気量Qは,電流(i)と時間(t)の積である。すなわち。腐食回路のアノードとカソードの電位差が変わらなければ,電流(生成する鉄イオン量)は水膜の電気抵抗(導電性)の影響を受けることになる。
水膜の電気抵抗は,水膜に含まれる電解質の質と量で決まる電気抵抗率(electrical resistivity)と水膜の厚みに依存する。なお,電気化学では,電気伝導率(electric conductivity)といわれる電気抵抗率の逆数が広く用いられる。
電気抵抗率は,例えば純水で約 10MΩ・cm,水道水で 10kΩ・cm程度,25℃の海水では約 19Ω・cmと水質で大きく変わる。
水膜の電気抵抗率が大きいと,電極間の距離によるIRドロップが大きく影響する。すなわち,アノードに近い狭い範囲しかカソードとして作用できなくなる。
逆に,電気抵抗率が小さい場合は,アノードから比較的離れた広い範囲がカソードとして作用できる。
腐食速度は,金属表面(カソード)に到達した酸素の量に影響されるので,水膜中の酸素拡散速度が同じであれば,腐食速度は,アノードの周りの有効なカソードの面積に比例することになる。すなわち,水膜の電気抵抗率が小さいと腐食量が大きくなる。
ページトップへ
主な用語の概説
酸化還元(oxidation-reduction)
酸化(oxidation)とは,原子が電子を失うことであり,単体のときより電子密度が低くなった状態である。失った電子の数を正 ( + ) の酸化数とする。
還元(reduction)とは,逆に電子を受け取ることで電子密度が高くなった状態である。受け取った電子の数を負 ( - ) の酸化数とする。
支持電解質(supporting electrolyte)
液体の導電性を高めるために添加する電解質。電解質(electrolyte)とは,水などの溶媒に溶けてイオン化し,その溶液が電気伝導性をもち,電流を通すと電気分解現象を起こすイオン性物質をいう。
ファラデーの電気分解の法則(Faraday's laws of electrolysis)
1833 年にイギリスの科学者マイケル・ファラデーによって発見された電気量と物質変化量の関係
●物質の量 m ( g ) は,流れた電気量(電流×時間)に比例する。電流 I ( A ) ×時間 t ( s ) =電気量 Q ( C ) なので,
m = K ・ I ・ t = K・Q
ここに,K :電気化学当量(比例定数)
● 1グラム当りの等量の物質を析出させるのに必要な電気量は,物質の種類によらず一定である。物質の分子量 M ( g / mol ) とすると,
m = ( MQ ) /( zF )
ここに,z :イオン価数,F :ファラデー定数 ( 9.6485×104 C/mol )
電気抵抗率(electrical resistivity)
物質の電気の通しにくさを表ために用いられる物性値で,単位はΩ・m(オームメートル)である。
絶縁性の高い樹脂などでは,表面を流れる電流の寄与を考慮した表面抵抗率(シート抵抗;sheet resistance)と内部を流れる電流に対する体積抵抗率(volume resistivity)とを区別して扱われる。
電気伝導率(electric conductivity)
溶液がもつ電気抵抗率(Ω・m)の逆数。溶液がもつ抵抗率の逆数で,電極間距離を電極表面積と電気抵抗との積で除した値。SI 単位は S/m(ジーメンス/メートル)。【JIS K 0213 「分析化学用語(電気化学部門)」】
注記 電気伝導率,電気伝導度及び測定セルのセル定数は,次の式で示す関係にある。
L=J×LX
ここに,L:測定試料の電気伝導率(S/m),J:セル定数( m-1 ),LX:測定した電気伝導度(S)
ページのトップへ