腐食概論:腐食の基礎
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “腐食概論(腐食の基礎)” ⇒
ここでは,腐食現象に関連し, 【均一腐食:表面の揺らぎ】, 【主な用語】 を紹介する。
腐食現象の分類
均一腐食:表面の揺らぎ
イオンや酸素の濃度差があると,【局部腐食:酸素濃淡電池】で解説するように,濃淡電池(concentration cell)が形成される。濃淡電池の電位差は,基本的にはネルンストの式(Nernst equation)に従う起電力(electromotive force)で説明される。
ネルンストの式 : E=E0+(RT/zF) ln(Ox/Red)
ここに,E0:標準電極電位,R:気体定数,T:絶対温度,z:反応に含まれる電子数
F:ファラデー定数,Ox:酸化側の活動度(活量),Red:還元側の活動度
ネルンストの式に従うと,溶存酸素濃度が Ox1から Ox2に変化した場合の電位差 ⊿E は次式で計算される。
⊿E=(RT/4F) ln(Ox1・Red2/Ox2・Red1)
多少強引ではあるが,雰囲気温度 20℃,還元側の水酸化物イオン(OH-)は直ちに拡散すると仮定すると,還元側の活動度変化は,酸化側の活動度変化(酸素濃度変化)ほどの変化がなく,Red1 ≒ Rwd2 とでき,電位差は,
⊿E≒15×10-3・log(Ox1/Ox2)
となる。
式から溶存酸素濃度の低い方がアノード(anode)になり,酸素の濃度差が 10倍のときに電位差約 15mV,100倍のときで 30mV と計算される。
実際には水酸化物イオンの影響を無視できないが,原理的に溶存酸素濃度の低い方がアノードになることが説明される。
同様に,鉄イオンの濃度差でも電池が形成される。鉄イオンは,水膜中で加水分解や酸塩基反応で固体の水酸化鉄(Ⅱ)として除去されるため濃度差を的確に予測できないが,鉄イオン濃度の低い方がアノードになる。
すなわち,腐食開始後しばらくすると,アノードの表面が溶解し鋼表面の不均一が変化するとともに,環境の不均一が進み,カソードであった部位がアノードに変わることが可能になる。
極端な例であるが,下図に示すイメージのように,ある段階でアノードがアノードであり続けるのが困難になるとともに,カソードの中にアノードになりうる個所が発生し,微小領域のアノードとカソードの対であるミクロ腐食電池(micro-galvanic cell ,単にミクロセルともいわれる)の移動が起きると考えられる。
実際には,水酸化鉄(Ⅱ)やオキシ水酸化鉄(含水酸化鉄)が鋼表面に沈着し,腐食に関連する成分の拡散障害になるなど複雑な過程を含むが,鋼表面の形状等の変化と環境の不均一を原因とするミクロ腐食電池の移動により均一な全面腐食になると考えられる。
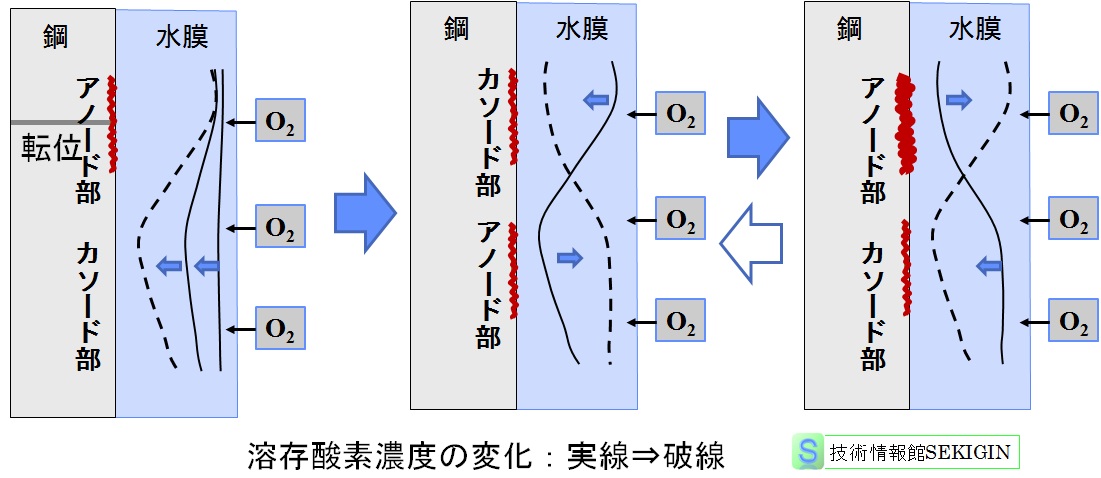
ミクロ腐食電池の移動(イメージ図)
ページのトップへ
主な用語の概説
濃淡電池腐食(concentration cell corrosion)
読み「のうたんでんちふしょく」,金属表面に接触する水溶液中のイオンや溶存酸素の濃度が局部的に異なるために生じた電池による腐食。【JIS Z0103「防せい防食用語」】
濃淡を原因とする電位差で生じた電池(マクロ腐食電池)による腐食で,広義の電池作用腐食(ガルバニック腐食;galvanic corrosion)の一種である。なお,酸素の濃淡電池形成の場合を通気差腐食(differential aeration corrosion)などともいう。
ネルンストの式(Nernst equation)
酸化還元反応: ox + ze- ⇆ red
が平衡状態の時,基準電極(標準水素電極)との電位差 E (平衡電極電位)を与える次式をネルンストの式という。
E = E0 + ( RT /zF ) ln ([ox] /[red] )
ここで,E0 :標準電極電位,R :気体定数( 8.314 JK-1mol-1 ),T :熱力学的温度( K ),z :酸化還元反応にて授受される電子数,F :ファラデー定数( 9.6485×104 C/mol ),ln :自然対数,[ox] :酸化型の化合物の活動度,[red] :還元型の化合物の活動度である。なお,25 ℃の時は,RT /F = 0.0592 となる。
起電力(electromotive force)
ガルバニ電池の外部回路に流れる電流を減少させて,ゼロになるときの電池の電位差の極限値。
ただし,電池の電位差は,いわゆる電池図の右側の電極に取り付けた金属端子の内部電位から左側の電極に取り付けた同種の金属端子の内部電位を差し引いたものである。
ファラデーの電気分解の法則(Faraday's laws of electrolysis)
1833 年にイギリスの科学者マイケル・ファラデーによって発見された電気量と物質変化量の関係
●物質の量 m ( g ) は,流れた電気量(電流×時間)に比例する。電流 I ( A ) ×時間 t ( s ) =電気量 Q ( C ) なので,
m = K ・ I ・ t = K・Q
ここに,K :電気化学当量(比例定数)
● 1グラム当りの等量の物質を析出させるのに必要な電気量は,物質の種類によらず一定である。物質の分子量 M ( g/ mol ) とすると,
m = ( MQ ) /( zF )
ここに,z :イオン価数,F :ファラデー定数 ( 9.6485×104 C/mol )
ミクロ電池腐食(micro-galvanic cell corrosion)
ミクロセル腐食,ミクロ腐食,均一腐食,全面腐食などともいわれ,鋼表面の表面状態,化学組成のわずかな違いから,微視的なアノード部とカソード部で構成されるミクロ腐食電池(micro-galvanic cell)が多数形成される。アノード部とカソード部の位置を移動しながら,全面が比較的穏やかで均一な腐食(全面腐食)を起こす。
ページのトップへ