第六部:生化学の基礎 たんぱく質(アミノ酸)
☆ “ホーム” ⇒ “生活の中の科学“ ⇒ “基礎化学(目次)“ ⇒
ここでは,たんぱく質の分子構造に関連し, 【たんぱく質の構造とは】, 【一次構造】, 【二次構造】, 【三次構造】, 【四次構造】, 【たんぱく質の構造と機能】 に項目を分けて紹介する。
たんぱく質の構造とは
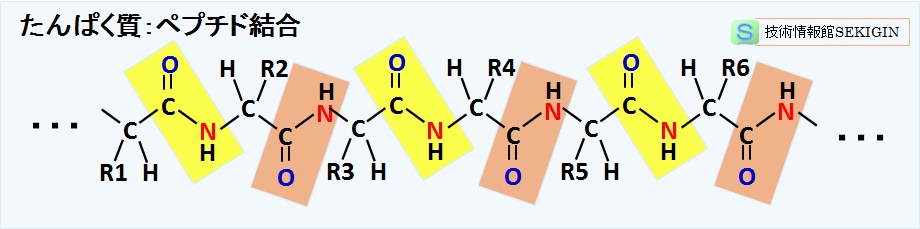
たんぱく質は,20種類のα-アミノ酸のうち,あるアミノ酸の一端のカルボキシ基と他のアミノ酸の一端にあるアミノ基の結合(ペプチド結合)を繰り返し,数百から数千のアミノ酸が結合した高分子化合物(巨大分子)である。
たんぱく質は,非常に長い分子になるため,水素結合などの分子内の相互作用により複雑な立体構造をとる。立体構造は,次に示すように,分子の特徴に応じて 4種に分類されのが一般的である。なお,たんぱく質特有の機能には,三次構造と四次構造が大きく影響している。
一次構造( primary structure )
DNA上に記された遺伝子の塩基配列で指定され,直鎖状<に結合したα-アミノ酸の配列をいう。
二次構造( secondary structure )
ペプチド結合に関与しているカルボニル基(―CO―)とアミド基(―NH )が水素結合を形成することで得られる規則的な構造である。
二次構造は,αへリックス,βシート,ランダム構造などと呼ばれる分子内の官能基の影響を受けた部分的な規則性を持つ。
三次構造( tertiary structure )
二次構造を保持しながら,側鎖間の相互作用によるポリペプチド分子全体の固有な立体構造をいう。
四次構造( quaternary structure )
複数のポリペプチド分子の相互作用による立体構造をいう。
たんぱく質の基本構造(ポリペプチド鎖)
ページのトップへ
一次構造
たんぱく質の基本構造は,前述したように,α-アミノ酸のカルボキシル基( −COOH )と別のα-アミノ酸のアミノ基( −NH2 )の脱水縮合によるペプチド結合( −CO−NH− )で多数重合したポリペプチド鎖である。
たんぱく質の代謝で紹介するように,アミノ酸の配列は,遺伝子の DNA の塩基配列( 3 個のヌクレオチドで 1 つのα-アミノ酸)で決定される。
すなわち,通常のポリペプチドは,分岐のない直鎖状の分子となるため,このアミノ酸の配列はたんぱく質固有の配列となるので,この配列をたんぱく質の一次構造という。
一次構造では,ポリペプチドの構造図におけるペプチド結合したアミノ酸部分( −NH−CH(−R)−CO− )をアミノ酸残基という。なお,たんぱく質の性質は,残基中の側鎖置換基 R の違いに依存する。
アミノ酸の配列に,システインなどの硫黄を含むα-アミノ酸が存在すると,アミノ酸残基がジスルフィド結合( S−S )の架橋構造をつくることもある。
この種のポリマーでは,末端の結合していない部分を N 端末(アミノ基側),C 端末(カルボキシル基側)という。この時には,アミノ酸の脇に側鎖が並ぶ事になるが,この配列の数や順序を指してたんぱく質の一次構造とよぶこともある。
ページの先頭へ
二次構造
たんぱく質や核酸などの生体高分子の主鎖の部分的な立体構造を二次構造という。二次構造には,αフェリックス,βシートなどがある。一つのたんぱく質分子には,複数の二次構造が存在できる。
αへリックス( alpha helix )
骨格となるα-アミノ酸のアミノ基(‐NH2 )は 4 残基離れたカルボキシル基(‐COOH )と水素結合を形成できる場合に,バネに似た右巻きのらせん形を作る。この構造をαへリックスという。
α-アミノ酸のアミノ基の N-H が 4 残基離れたカルボキシル基の C=O との距離( N … O 間)が 0.28 nm と水素結合には適当で,会合エネルギーが最大となる。
例えば,ミオグロビン(筋肉中の酸素分子を貯蔵する色素タンパク質)では全体の 70%程度が 8つのαヘリックスで構成され,残りがランダム構造である。
2つ以上のαヘリックスが互いの周りを囲むスーパーコイル構造をコイルドコイルといい,ケラチンやミオシンのような繊維状たんぱく質に見られる。
βシート(βsheet ,β-pleated sheet )
隣り合ったペプチド鎖の間で,一方の主鎖の N-H が隣接する主鎖の C=O と水素結合を形成し,全体として平面構造を形成しているものをβシートという。すなわち,水素結合が 2本のポリペプチド鎖の間にある。βシートには,平行βシートと逆平行βシートに分けられる。
ページの先頭へ
三次構造
たんぱく質を構成するポリペプチド鎖は,二次構造(αヘリックスやβシートなど)の特定の組み合わせが,ループやターンと呼ばれる構造に折り畳まれ,局部的に集合した超二次構造やモチーフ呼ばれるβヘアピンやαヘアピンなどの単位ができ,部分的にまとまったたんぱく質ドメインを複数形成する。
このドメインの構造を含めたタンパク質全体の立体的な構造を三次構造という。なお,全てのポリペプチド鎖が明確な三次構造を持っているわけではない。
たんぱく質ドメイン( protein domains )
たんぱく質分子が構造上複数の領域に分けることができる場合の領域をいう。多くのたんぱく質が幾つかのドメインを持ち,それぞれは,独立に折り畳まれ安定化されることが多い。なお,ドメインの長さは様々で,アミノ酸残基 25 程度から 500 残基以上に及ぶものもある。
ページの先頭へ
四次構造
三次構造までは,一つのポリペプチド鎖における構造である。四次構造は,折り畳まれた複数のポリペプチド鎖の会合で構成される空間配置(コンホメーション)を意味する。
たんぱく質の多くは,2 本以上のポリペプチド鎖の集合体である。集合体における個々のポリペプチド鎖をサブユニットと呼ぶ。
サブユニットの三次構造に加え,複数のサブユニットから成る空間配置を四次構造といい,多彩な機能を持つホロ酵素,ヘモグロビン,DNAポリメラーゼ,イオンチャネル,ヌクレオソーム,微小管などが四次構造を持つ。
ページの先頭へ
たんぱく質の構造と機能
たんぱく質の機能は,上記の三次構造・四次構造で決定される。このことは,同じ一次構造(アミノ酸配列)のたんぱく質でも立体構造の違いで機能が変わることを意味する。
例えば,狂牛病(牛海綿状脳症,BSE )の原因といわれるたんぱく質の異常プリオンは,一次構造が同じでαヘリックス構造が多い正常なプリオンに比較し,βシート構造が多い立体構造を持つ。
一般的には,多くのたんぱく質は,熱,圧力,pH 変化などの操作で,二次以上の高次構造が変化するため,たんぱく質としての機能(活性)を失う(たんぱく質の変性)。
変性したたんぱく質は,全体にランダムな構造が増加したペプチド鎖の緩んだ状態になることが知られている。
ページの先頭へ