腐食概論:金属概論
☆ “ホーム” ⇒ “腐食・防食とは“ ⇒ “金属概論” ⇒
金属の基礎
金属の化学的特徴
陽子,中性子,その他素粒子からなる原子核(atomic nucleus)は,半径10-14~10-15mで,結合距離10-9~10-11mに比べて非常に小さい。
原子(atom)は,小さな原子核を中心に,その周りを電子が取り囲んでいる。中性の原子では,原子核を取り囲む電子の数は陽子の数と同じになる。
プラスの電荷を持つ陽子の周りをマイナスの電荷を持つ電子が取り囲んでいるが,電子は,陽子との静電相互作用によって決まるとびとびのエネルギー順位(energy level)しか採れない。
それぞれのエネルギー順位は,電子に軌道を割り当てることになる。各軌道には,パウリの排他原理(Pauli principle)「一つの軌道にはスピンの方向が異なる 2つの電子しか存在できない」により,同じエネルギー順位には 2個までしか電子が入れない。
複数の電子を持つ原子では,電子‐電子間の相互作用によるエネルギー順位が与えられる。電子に与えられる軌道は,エネルギー順位の低い方から,1s,2s,2p,3s,3p,3d,・・・と区分されている。
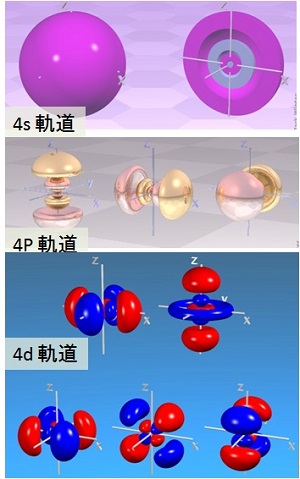
電子軌道の例
出典:Sheffield大学(英国)Winter Group HP
チタン(Ti),鉄(Fe),銅(Cu),亜鉛(Zn)などの実用実績の多い金属原子が属する周期表第 4周期の元素について,外殻の電子軌道(electron orbital)の例を図「電子軌道の例」に示した。
s軌道は,原子核を中心に球状に 2個の電子が分布する。p軌道は,原子核を中心に,X軸,Y軸および Z軸方向に伸びる電子分布となり,それぞれに 2個,合計 6個の電子が分布する。d軌道は図に示すように,合計 10個の電子が複雑な分布を示す。
原子の周りの電子は,エネルギーの低い軌道から埋まり,最も外側の電子を最外殻電子(outermost electron)という。最外殻電子は,その元素の化学的性質を決定する。周期表の族は,下表の「各元素の外殻軌道の電子配置」に示すように,最外殻電子の軌道が同じ種類になっている。
個体の金属では,原子が密集した状態となり,外殻の電子軌道が原子間の相互作用により,各軌道の電子がとれるエネルギー順位が細かく分裂する。
エネルギー順位としては,連続していないが,原子数に比例して分割するため,固体の金属では,あたかも連続しているような様相を示す。これをエネルギーバンド(energy band)という。
金属元素では,最外殻電子の持つエンルギーバンドにおいて,電子に満たされたエネルギーバンド(充満帯)と電子を含まないエネルギーバンド(空準位)のエネルギーギャップが小さくなり,充満帯の電子が比較的自由に空順位に移ることができ,隣り合う原子の間を自由に動き回る自由電子(free electron)になる。
自由電子が各原子をクーロン力で結びつけることになり,この結合を金属結合(metal bond)という。エネルギーバンド間のギャップが大きく電子が移動できない結晶は,不導体の非金属結晶となり,エネルギーバンド間のギャップが比較的小さく,ある条件が整うと導体になったり不導体となる物質は,半導体と呼ばれる。
金属の性質と自由電子
自由電子の存在が,金属の性質をもたらす。すなわち,物体が外力で変形した場合に,イオン結合や共有結合の物質では結合が破壊するのに対し,金属結合では結合電子が自由に動き回るため,陽子の移動が起きても,周りの電子が動ける範囲で結合は破壊されない。このため,金属特有の延性(ductility)や展性(malleability)が生まれる。自由電子は,ほとんどの可視光を反射(種々の波長の光を吸収し,再放出)するため,金属光沢と称される光沢を有する。
電荷を持つ電子が容易に移動し,電極間に電荷を受け渡すことができるため,自由電子を持たない物質での固体内のイオン移動に比較して著しく高い導電性を持つ。
熱の伝導は,電子や原子の振動エネルギーとして伝わる。金属では自由電子の振動で熱が伝わるのに対し,自由電子を持たない物質では,原子間の振動で伝わる。電子間の振動の伝搬に比較し,自由電子の振動伝搬が速いため,金属は熱の良導体となる。
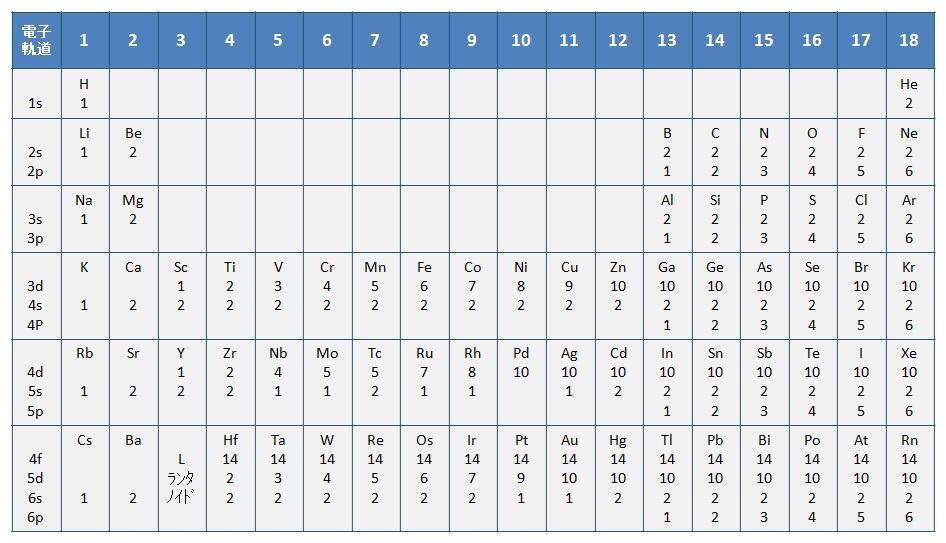
各元素の外殻軌道の電子配置
パウリにより提唱された原理で,排他律あるいは禁制原理などとも呼ばれる。「 2つ以上のフェルミ粒子は,同一の量子状態を占めることはできない。」と表現され,一つの原子内では,2 個以上の電子が同時にエネルギー・スピンなどの同じ状態をとることはないことを示す原理である。
【参考資料】
1)大澤直 『金属のおはなし』 日本規格協会,2008年
2) 伊藤尚夫,無機化学シリーズ11「金属元素の化学」培風館,1972年
3) 齋藤勝裕 『金属のふしぎ』 ソフトバンククリエイティブ,2009年
ページのトップへ